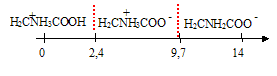Concours
Paces paramédicaux, UE1 Strasbourg 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
......
.....
|
001.
Les deux isotopes stables du cuivre ( Z = 29) naturel possèdent 34 et
36 neutrons. Vrai.
On donne : les deux isotopes stables du cuivre naturel : 63Cu
et 65Cu.
63Cu compte 63 -29 = 34
neutrons.
65Cu
compte 65 -29 = 36 neutrons.
002. La masse molaire du dihydrate
de sulfate de calcium est égale à 172,17 g / mol. Vrai.
CaSO4, 2H2O.
M = 40,08 +32,06 + 4x16,00 +2 x18,016 =172,172 g / mol.
003. Le composé de
formule BrCs est un composé ionique. le numéro atomique du césium est Z
= 55. Vrai.
Le césium appartient à la famille des alcalins et le brome à celle des
halogènes.
.
004. La série de
Balmer donne les longueurs d'onde dans le visible du spectre atomique
du carbone. Faux.
La série de Balmer donne les longueurs
d'onde dans le visible du spectre atomique de l'hydrogène.
005. Dans le modèle quantique de
l'atome, une orbitale atomique s occupe un volume d'autant plus grand
que l'énergie des électrons qu'elle contient est élevée. Vrai.
006. Dans la configuration électronique de l'ion
sulfure et de l'ion potassium, les trois orbitales 3p sont entièrement
remplies d'électrons. Vrai.
K+ : 1s2 2s2 2p6 3s2
3p6 ; S2- : 1s2 2s2 2p6
3s2 3p6 .
007. La configuration électronique de l'argent
constitue une exception aux règles de remplissage. Vrai.
On donne la configuration électronique de l'argent : [Kr] 5s1
4d10.
Un électron passe de l'orbitale 5s à l'orbitale 4d.
008. L'affinité électronique des métaux alcalins est
supérieure à celle des halogènes. Faux.
Les halogènes ont terdance à capter un électron pour former un ion
halogénure. Ils possèdent de grande affinité électronique.
009. Un atome de sodium et un atome de chlore
distants de 2000 pm et à l'état gazeux forment une paire d'ions. Faux.
A l'état solide la distance des ions sodium et chlorure est voisine de
300 pm.
Pour les questions 10 à 12, on donne : ozone O3 ; entalpie
de liaison entre deux atomes d'oxygène +157 kJ / mol.
010. Les liaisons covalentes de l'ozone étant
faibles, cette molécule est peu stable. Vrai.
011.
Le modèle de Lewis de l'ozone fait apparaître
une charge formelle positive sur l'atome d'oxygène central. L'écriture
de deux structures de résonance fait apparaître une charge formelle
négative sur l'un ou l'autre des atomes d'oxygène latéraux. Vrai.
 012. Le modèle de Lewis de l'ozone fait apparaître
une hybridation sp2 de l'oxygène central. Vrai.
012. Le modèle de Lewis de l'ozone fait apparaître
une hybridation sp2 de l'oxygène central. Vrai.
Pour les questions 13 à 14 on donne les électronégativités dans
l'échelle de Pauling :
X(S) =
2,6 ; X(F) = 4,0.
013. Dans l'hexafluorure de soufre SF6, ni l'atome
de soufre, ni l'atome de fluor ne sont tenus de respectés la règle de
l'octet. Faux.
014. L'hexafluorure de soufre présente une
géométrie octaèdrique et ce composé n'est pas polaire. Vrai.
015. L'angle de valence HNH est plus grand dans NH3
que dans NH4+. Faux.
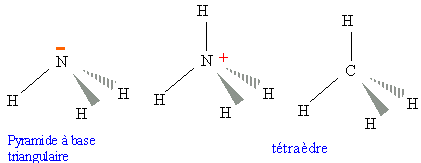
NH4+ tétraèdre, angle HNH
= 109 °.
NH3, les répulsions entre le doulet libre de l'azote et un
doublet de la liaison NH ferment l'angle.
angle HNH =
107 °.
|
...
|
|
Pour
les questions 16 à 18 on donne le diagramme d'orbitales moléculaires
pour la construction des configuration électroniques de X2 et X2+ où X = H, He.
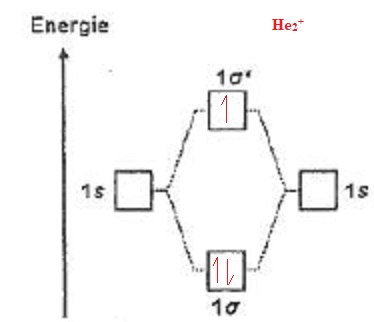
016. La théorie des orbitales moléculaires prévoit que He2+ est paramagnétique. Vrai.
Présence d'un électron célibataire.
017. La théorie des orbitales moléculaires prévoit que l'ordre de liaison dans H2+ est égal à 1. Faux.
(nombre d'électrons des niveaux liants - nombre d'électrons des niveaux antiliants ) / 2 = (1-0) / 2 = 0,5.
018. Pour H2 à l'état fondamental, HOMO est liante. Vrai.
HOMO : orbitale moléculaire occupée de plus haute énergie occupée par au moins un électron.
Pour les questions 19 à 22 on donne :
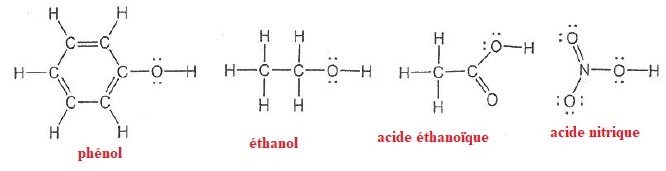
pKa(phénol / phénolate) = 10. pKa(acide acétique / ion acétate) = 4,7.
019. L'acide nitrique et l'acide éthanoïque sont des oxacides respectivement fort et faible. Vrai.
020. Le phénol est un acide plus fort que l'éthanol parce que sa base conjuguée est stabilisée par effet mésomère. Vrai.
021. L'acide acétique est un acide plus fort que le phénol. Vrai.
Plus le pKa du couple ( acide / base) est faible, plus l'acide est fort.
022. La réaction de l'acide acétique dans l'eau s'écrit :
CH3COOH +H2O ---> CH3COO- +H3O+. Faux
( cette réaction est partielle , elle conduit à un équilibre. Remplacer la flèche par une double flèche)
Pour les questions 23 à 25 on donne acide formique HCOOH ; pKa(acide formique / ion formiate) = 3,8.
023. Le pH d'une solution d'acide formique à 0,1 mol / L est égal à 0,8. Faux.
pH = 0,5 (pKa - log 0,1) = (3,8 +1) / 2 = 2,4.
024.
Le point d'équivalence du titrage de 20 mL d'acide formique à 0,1 mol /
L par l'hydroxyde de sodium à 0,05 mol / L est obtenu lors de
l'addition de 10 mL de la solution basique. Faux.
A l'équivalence CaVa = CbVb ; Vb =0,1 x20 / 0,05 = 40 mL.
025.
Au point de demi-équivalence du titrage de 20 mL d'acide formique à 0,1
mol / L par l'hydroxyde de sodium, le taux d'ionisation de l'acide
formique est de 50 %. Vrai.
Pour les questions 26 à 27 on donne les pka de la glycine : 2,4 ; 9,7 et la structure de Lewis de la glycine 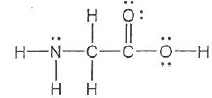
026.
On considère une solution aqueuse de glycine à 0,1 mol / L. Si seul la
forme zwitterion de la glycine est présente dans la solution, alors le
pH est égal à 7,25. Faux.
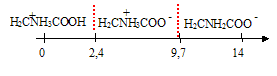
(2,4 +9,7) / 2 = 6,05.
027.
On considère une solution aqueuse à 0,1 mol / L de glycine. Si le pH de
la solution est égal à 1, il n'y a qu'une espèce prédominante en
solution et celle-ci est chargée négativement. Faux.
Pour les questions 28 et 29 on donne la réaction entre le monoxyde de carbone et l'oxyde de fer (III).
a CO +b Fe2O3 = c Fe + d CO2.
028. Le nombre d'oxydation du carbone est égal à +II dans CO et +IV dans CO2. CO est donc l'oxydant. Faux.
CO est le réducteur qui s'oxyde.
029. Les coefficients stoechiométriques sont a = 3 ; b = 1 ; c = 2 et d = 3. Vrai.
3 CO + Fe2O3 = 2 Fe + 3 CO2.
Pour les questions 30 à 32 on donne :E°(Cu2+/Cu) = 0,34 ; E°(Zn2+/Zn) = -0,77 V.
030. Le cation Zn2+ est un oxydant plus fort que la cation Cu2+. Faux.
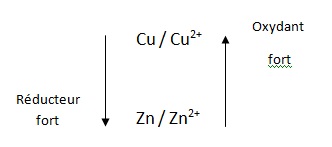
031. La
réaction entre Zn et Cu2+ implique l'échange de deux électrons.
Cette réaction est quantitative dans les conditions standard. Vrai.
032. L'écriture Zn / ZnCl2//CuSO4 /Cu désigne une cellule électrochimique électrolytique. Faux.
C'est celui d'une pile.
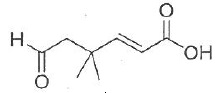
033. La molécule suivante est l'acide (E)-6-oxo-4,4-diméthylhex-2-ènoïque. Vrai.
034. La molécule représentée ci-dessous est un aldehyde. Faux.
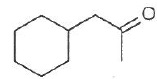
C'est une cétone.
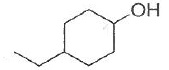
035. La molécule suivante est le 4-éthylcyclohexanol. Vrai.
036. La molécule suivante possède 2 stéréoisomères. Vrai.
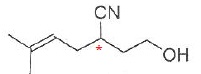
Le carbone doublement lié porte deux groupes méthyles identiques : pas d'isomérie Z / E.
Présence d'un atome de carbone asymétrique : 2 énantiomères.
37. La molécule suivante notée F est le (R)-butan-2-ol. Faux.
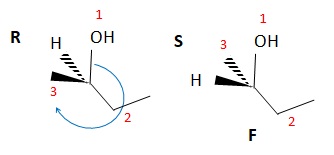
038. Les deux molécules suivantes sont des énantiomères. Vrai.

Image l'une de l'autre dans un miroir plan.
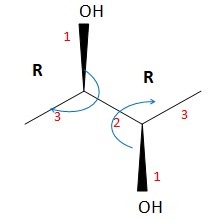
039. Les deux molécules suivantes sont des énantiomères. Vrai.
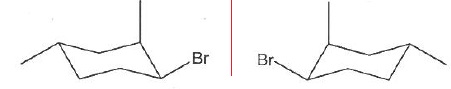
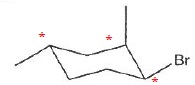
040. La molécule suivante possède trois atomes de carbone asymétriques. Vrai.
041. La molécule suivante est de configuration 2R 3S. Faux.
042. La molécule suivante est le ( 2R, 5R, 3Z)-hex-3-ène-2,5-diol.
Vrai.
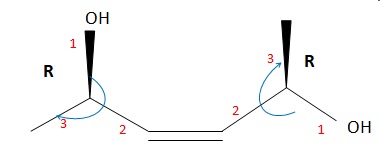
043. La molécule précédente est un composé méso. Faux.
Il
y a deux atomes de carbone asymétriques, un plan de symétrie, mais les
centres stéréogènes ne sont pas de configuration opposés par rapport au
plan.
Les questions 044 à 047 sont liées.
044. La molécule suivante est de configuration S. Faux.
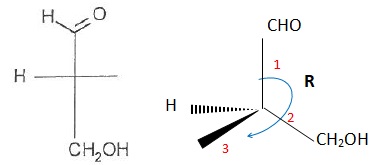
045. Il s'agit du (R)-3-hydroxypropanal. Faux.
046. Il s'agit du (S)-2-méthyl-3-hydroxypropanal. Faux.
(R)-2-méthyl-3-hydroxypropanal.
047. L'énantiomère de A peut être représenté de la façon suivante. Vrai.
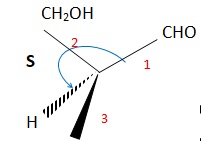
Les questions 048 à 050 sont liées.
048. Les molécules A et B sont identiques.
Faux.
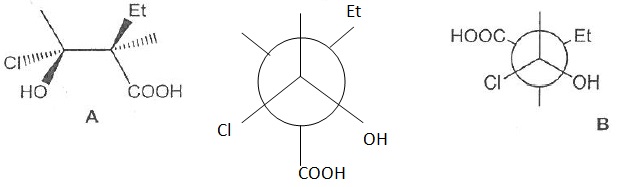
049. Ce sont des diastéréoisomères. Vrai.
La configuration absolue d'un seul atome de carbone asymétrique a changé.
050. Ce sont des énantiomères. Faux.
|
....
|
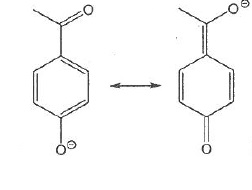
051. Les représentations suivantes sont les forme mésomères d'une même molécule. Vrai.
052. Le classement des acides suivants par ordre d'acidité croissante est A < B < C. Faux.
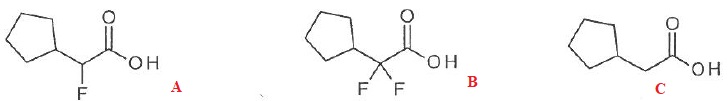
C < A < B.
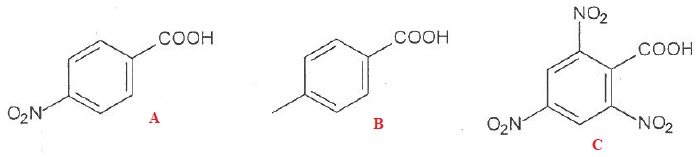
53. Le classement des acides suivants par ordre d'acidité croissante est B < A < C. Vrai.
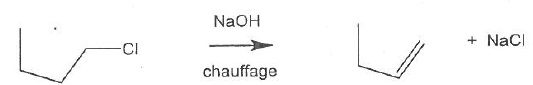
054. La réaction suivante est une élimination de type E1. Vrai.

Le carbocation est stabilisé par les trois groupes méthyles.
055. La réaction suivante est une élimination de type E2. Vrai.
056. Dans la réaction d'élimination suivante, il ne peut se former que deux produits différents. Vrai
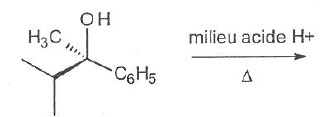
057. La réaction suivante est une substitution de type SN2. Vrai.
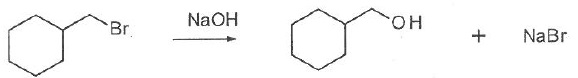
058. La réaction suivante est une substitution de type SN2. Faux.
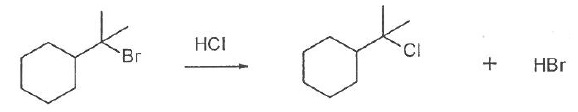
Le carbocation est stabilisé par les groupes alkyles donneurs.
059. La réaction suivante est une réaction d'addition. Faux.
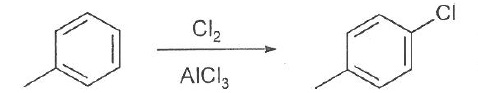
Substitution électrophile.
060. Le produit formé B est une cétone. Vrai.
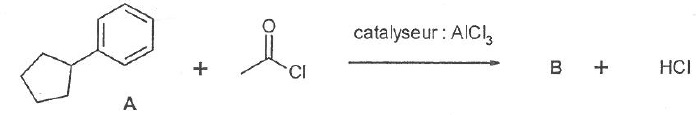
061. La réaction ci-dessous est une substitution radicalaire. Vrai.
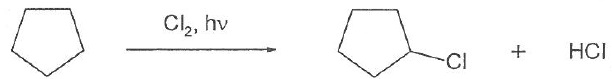
062. L'eau et l'éthanol sont des solvants protiques. Vrai.
Solvants polaires possèdant au moins un hydrogène susceptible d'intervenir dans des liaisons hydrogènes.
063. L'hexane et le benzène sont des solvants protiques. Faux.
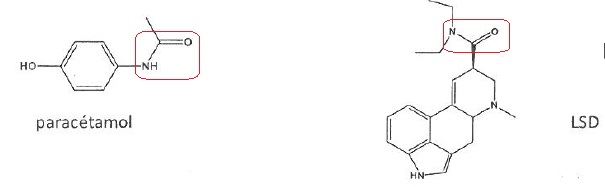
064.
Les molécules ci-dessous ont une fonction amide.
Vrai.
|
|