Étude de la corrosion
des armatures métalliques d’un béton armé,
Caplp maths sciences 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Étude des réactions acido-basiques dans le béton.
La carbonatation des bétons est une des causes de la corrosion
des structures métalliques du béton armé. Elle résulte de l’action
naturelle du dioxyde de carbone de l’atmosphère, qui diffuse sous forme
gazeuse dans le réseau poreux du béton et se dissout en formant de
l’acide carbonique au contact de la solution aqueuse interstitielle.
36. Donner l’équation de la réaction de formation de l’acide carbonique H2CO3.
H2O + CO2 = H2CO3.
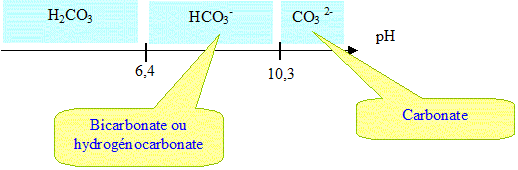
37. Les deux couples acido-basiques relatifs à l’acide carbonique sont H2CO3 / HCO3- et HCO3- / CO32-, associés respectivement aux constantes d’acidité Ka1 et Ka2. Donner l’expression de Ka1 et Ka2 en fonction des concentrations des acides et bases conjugués de chaque couple.
On donne pKa1 = 6,4 et pKa2 = 10,3.
Ka1 = [HCO3-] [H3O+] / [H2CO3].
Ka2 = [H3O+] [CO32- ]/ [HCO3-].
38. Donner le diagramme de prédominance des deux couples acido-basiques.
 Le
déséquilibre ionique de la solution aqueuse interstitielle conduit à
son tour à la dissolution des hydrates du ciment, et notamment de la
portlandite Ca(OH)2 qui possède un effet tampon sur le pH, et à la formation de calcite CaCO3.
Le
déséquilibre ionique de la solution aqueuse interstitielle conduit à
son tour à la dissolution des hydrates du ciment, et notamment de la
portlandite Ca(OH)2 qui possède un effet tampon sur le pH, et à la formation de calcite CaCO3.
39. Le pH initial
d’un matériau sain est de 13. Donner l’équation de la réaction entre
l’acide carbonique et la portlandite. Pourquoi la portlandite a-t-elle
un effet tampon ?
CO2 + Ca(OH)2 =CaCO3 + H2O.
L'équilibre de dissolution Ca(OH)2 =Ca2+ +2HO- est déplacé vers la droite et la portlandite a
un effet tampon.
Lorsque la portlandite, principale source de basicité de la solution
aqueuse interstitielle, a été en grande partie consommée, le pH chute à une valeur inférieure à
9, permettant ainsi la dépassivation des armatures en acier et le démarrage de la corrosion
dans certaines conditions d’humidité et d’accessibilité de l’oxygène aux sites
réactifs.
On donne :
Fe(OH)2(s) : pKs =15
Fe(OH)3(s) : pK's =38
Fe3+ / Fe2+ : E1° =0,77 V.
Fe2+ / Fe : E2°=-0,44 V
À la température T considérée, RT / F log(10) vaut environ 0,06 V, R et F étant les constantes des gaz parfait et de Faraday.
40. Donner les expressions des constantes de dissociation Ks et K's en fonction des concentrations des espèces concernées. Calculer le pH de
précipitation de l’hydroxyde de fer II ainsi que celui de l’hydroxyde de fer III pour une concentration
de tracé C1 du diagramme potentiel –pH de 1,0. 10−6 mol. L−1.
Ks =[Fe3+] [HO-]3 =10-38.
[HO-]3 =10-38/10-6=10-32 ; [HO-] =2,15 10-11 mol / L.
pH de début de précipitation de
Fe(OH)3(s) :
(H3O+]=10-14 / (2,15 10-11)=4,6 10-4 mol / L ; pH =3,3.
K's =[Fe2+] [HO-]2 =10-15.
[HO-]2 =10-15/10-6=10-9 ; [HO-] =3,16 10-5 mol / L.
pH de début de précipitation de
Fe(OH)2(s) :
(H3O+]=10-14 / (3,16 10-5)=3,16 10-10 mol / L ; pH =9,5.
41. Donner l’expression du potentiel E en fonction du pH pour le
couple Fe2+ / Fe et une concentration de tracé de 1,0. 10−6 mol / L. On
distinguera au besoin plusieurs zones de pH.
pH < 9,5 : E = E°(Fe2+/Fe) +0,03 log [Fe2+]
E = -0,44 +0,03 log(10-6)= -0,62 V.
pH > 9,5 : E = E°(Fe2+/Fe(OH)2) +0,03 log ([Fe2+][HO-]2).
E = E°(Fe2+/Fe(OH)2) +0,03 log ([Fe2+](10-14/[H3O+])2).
E = E°(Fe2+/Fe(OH)2) +0,03 log (10-6 x10-28/[H3O+])2).
E = E°(Fe2+/Fe(OH)2) -1,02-0,06pH.
A pH = 9,5; E = -0,62 V ; E°(Fe2+/Fe(OH)2) -1,02-0,06x9,5=-0,62.
E°(Fe2+/Fe(OH)2)=0,97 V.
E = -0,05-0,06pH.
42. Donner l’expression du potentiel E en fonction du pH pour le
couple Fe3+ / Fe2+ et une concentration de tracé de 1,0. 10−6 mol. L−1. On distinguera au besoin
plusieurs zones de pH.
pH < 3,3 : E = E°(Fe3+/Fe2+) +0,06 log ([Fe3+]/[Fe3+])=0,77 V.
9,5 > pH >3,3 : E = E°(Fe(OH)3/Fe2+) +0,06 log (1/([Fe2+][HO-]3).
E=E°(Fe(OH)3/Fe2+) +0,06 log ([H3O+])3/([Fe2+](10-14)3).
E=E°(Fe(OH)3/Fe2+) -0,18pH +0,06 log (1/(10-6 x 10-42).
E=E°(Fe(OH)3/Fe2+) -0,18pH +2,88
A pH = 3,3; E = 0,77 V ;
0,77 =E°(Fe(OH)3/Fe2+) -0,18x3,3 +2,88 ; E°(Fe(OH)3/Fe2+)= -1,516 V.
E=-1,516 -0,18pH +2,88.
E = 1,364-0,18pH.
pH >9,5 : E = E°(Fe(OH)3/Fe(OH)2) +0,06 log (1/[HO-]).
E=E°(Fe(OH)3/Fe(OH)2) +0,06 log ([H3O+]/10-14).
E=E°(Fe(OH)3/Fe(OH)2) -0,06 pH +0,84.
A pH = 9,5 : E = -0,328 V ;
-0,328=E°(Fe(OH)3/Fe(OH)2) -0,06 x9,5 +0,84.
E°(Fe(OH)3/Fe(OH)2)=-0,598 V.
E=0,242 -0,06 pH.
43. Le diagramme potentiel-pH du fer trouvé sur un site Internet a été construit avec une concentration de tracé de 1,0. 10−1 mol. L−1.
Compléter ce diagramme pour une concentration
de tracé de 1,0. 10−6 mol. L−1.
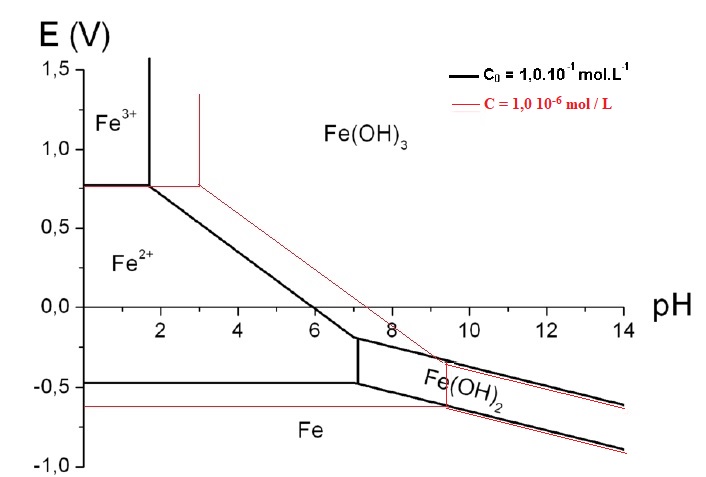
44. Commenter. Expliquer en particulier pourquoi lorsque le pH
diminue, on peut observer une dépassivation des armatures en acier.
Une pellicule protectrice Fe2O3CaO formée par
action de la chaux libérée par les silicates de calcium protège
le fer de la corrosion tant que le pH est supérieur à 9. ( la présence
de la chaux maintient une basicité élevée du milieu entourant les
armatures en fer ).
|
|
....
|
45.
Une corrosion a lieu sur les barres qui constituent l'armature
métallique dans le béton armé lorsque le processus de carbonatation du
matériau atteint ces mêmes barres. Il y a alors formation de
"micro-piles" d'oxydo-réduction au sein de la structure.
Les couples à
prendre en compte sont Fe2+ / Fe(s) et O2(g) / HO-.
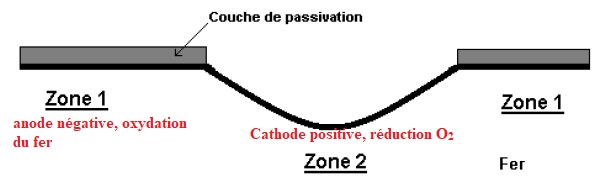
En supposant que la
couche de passivation constitue une électrode en Zone 1, indiquer sur
le schéma où sont
l’anode et la cathode en le justifiant. Préciser également où sont les
pôles + et - de la micro-pile et donner l’équation globale de corrosion
au niveau d'une barre métallique de l'armature lorsque le béton n’est
pas trop dégradé (pH > 9,5).
Anode négative : oxydation du fer en Fe2+selon Fe(s) = Fe2+aq +2e-.
Cathode positive, réduction du dioxygène selon ½O2(g) + 2e-+H2O =2HO-aq.
Fe(s) +½O2(g) +H2O =2HO-aq +Fe2+aq.
46. Les volumes relatifs du fer et des
produits de corrosion sont vosins de : volume produits de la corrosion / volume du fer ~ 4. Quels sont les
conséquences sur le béton armé dont la structure métallique est soumise
à la corrosion ?
Les oxydes de fer étant plus volumineux que l'acier provoquent des
contraintes internes dans le béton qui peuvent être supérieures à sa
résistance en traction ( éclatements localisés, formation de
fissures )..
La protection cathodique des armatures métalliques
dans un béton est un traitement appliqué de façon permanente qui permet
de ralentir, voire d’arrêter leur corrosion. Le principe
de la protection cathodique consiste à polariser l’armature dans le
béton, à l’aide d’une anode placée de façon permanente sur le parement
ou parfois dans l’enrobage. Le courant de polarisation, qui circule de
l’anode vers l’armature, se situe entre 2 et 50 mA par mètre-carré
de surface d’armature. L'anode est directement reliée à l’armature.
47.
L’anode est en zinc. Le couple à prendre en compte est : Zn2+ / Zn(s).
L’autre couple mis en jeu est : O2(g) / HO-. En considérant des barres
verticales en zinc de 10 mm de diamètre et de 6 m de long placées dans
le béton et espacées de 20 cm, déterminer la masse maximale de
zinc perdue par corrosion dans le treillis anodique en une année sur un
mur de 6 m de hauteur et 10 m de longueur. On donne M(Zn)=65,4
g.mol−1 et F=9,65.104 C.mol−1. Commenter la valeur trouvée
sachant que la masse volumique du zinc est de 7,13 103 kg m-3.
Zn(s) = Zn2+aq +2e-.
½O2(g) + 2e-+H2O =2HO-aq.
Zn(s) +½O2(g) +H2O =2HO-aq +Zn2+aq.
Surface du mur : 6 x 10 = 60 m2.
Intensité maximale du courant I = 0,050 x60 =3,0 A.
Un an = 365 x24 x3600 =3,2 107 s.
Quantité d'électricité Q = I t = 3 x 3,2 107 ~9,5 107 C.
Quantité de matière d'électrons : 9,5 107 / (9,65 104) ~9,8 102 mol.
Quantité de matière de zinc : 9,8 102 / 2 = 4,9 102 mol.
Masse de zinc : 4,9 102 x65,4 =3,2 104 g = 32 kg.
Volume de zinc : 32 / (7,13 103) ~4,5 10-3 m3.
Volume d'une barre de zinc : pR2h =3,14 x (5 10-3)2 x 6 =4,7 10-4 m3.
Nombre de barres de zinc dans ce mur : 50.
Volume de ces barres : ~ 2,4 10-2 m3.
Avec un courant maximal de 50 mA par m2, la protection anodique dure 5 ans.
La peinture des ouvrages de génie civil
a pour but de contribuer à la protection du béton.
48. L’acétate de
vinyle CH2=CH-O-C(CH3)=O) est un monomère utilisé dans les peintures
vinyliques. Afin d’avoir une meilleure idée de la géométrie de cette
molécule, en donner la formule topologique.
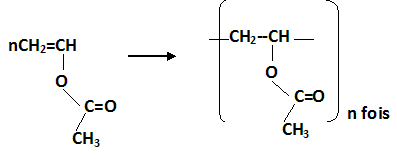
49. L'acétate de polyvinyle
est utilisé comme adhésif et dans les peintures à séchage rapide.
Donner la formule topologique de ce polymère.
50. Pourquoi un film
étanche permet-il d’augmenter la durabilité du béton armé ?
Le dioxygène de l'air et CO2 ne peuvent pas pénétrer dans le béton : pas de carbonatation et pas d'oxydation du fer.
|
|



