Fontaines
pétrifiantes, sel et corrosion. Concours CAPLP
2018.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Fontaines pétrifiantes.
Dans une galerie souterraine profonde, la pression partielle de dioxyde de carbone PCO2 est constante, égale à 0,35 bar et la température de l'eau est de 25°C.
31. Tracer le diagramme de prédominance des espèces CO2 aq, HCO3- et CO32-. Quelles sont les formes prédominantes à pH = 6 ?
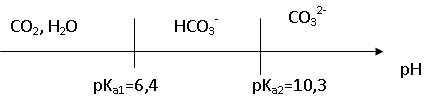 A pH = 6, CO2 aq et HCO3- prédominent.
32. Calculer la concentration de CO2 aq dans l'eau souterraine.
A pH = 6, CO2 aq et HCO3- prédominent.
32. Calculer la concentration de CO2 aq dans l'eau souterraine.
CO2 aq + 2H2O = HCO3- + H3O+.
[HCO3- ]=[ H3O+] =10-6 mol/ L.
Conservation de l'élément carbone :
Ka1 = 10-6,4 = 3,98 10-7 =x2 / (C-x) avec x = 10-6 mol/ L avancement volumique.
C -x = x2 / Ka =10-12 / (3,98 10-7)=2,51 10-6 mol / L.
33. Ecrire la condition d'électroneutralité pour une eau souterraine initialement pure ( sans ion Ca2+).
A pH = 6, [HO- ] et [CO32-] sont négligeables.
[ H3O+] = [HCO3- ].
34. En
considérant que le dioxyde de carbone est le seul responsable du pH de
l'eau, en déduire que le pH d'une eau souterraine pure est d'environ 4.
A 298 K l'équilibre CO2(g) = CO2 aq a pour constante d'équilibre K° = 3,4 10-2.
K° =[CO2 aq] / P CO2 ; [CO2 aq] = K°P CO2 = 0,35 x 3,4 10-2= 0,0119.
Ka1 = 10-6,4 = 3,98 10-7 =x2 / (C-x) avec C =0,0119.
x2+3,98 10-7 x -0,0119 *3,98 10-7 =0.
x2+3,98 10-7 x -4,74 10-9 =0.
Discriminant D =(3,98 10-7)2 +4 *4,74 10-9 = 1,894 10-8 =(1,376 10-4)2.
Solution retenue : (-3,98 10-7 +1,376 10-4) / 2 =6,86 10-5.
pH = -log(x) ~4,16.
35. Ecrire la réaction qui se produit lorsque cette eau rencontre des roches calcaires en ne considérant que CaCO3. Justifier que le pH de l'eau augmente. Produit de solubilité du carbonate de calcium : Ks = 10-8,3.
CaCO3(s) + H3O+aq = Ca2+ aq+ HCO3-aq + H2O(l).
Des ions H3O+aq sont consommés, le pH de l'eau croît.
36. Indiquer le sens d'évolution du pH lorsque la pression partielle de CO2 atteint 4,0 10-4 bar sachant que la pression totale est 1,0 bar. Justifier.
A 298 K l'équilibre CO2(g) = CO2 aq a pour constante d'équilibre K° = 3,4 10-2.
K° =[CO2 aq] / P CO2 ; [CO2 aq] = K°P CO2 = 4,0 10-4 x 3,4 10-2= 1,36 10-5.
Ka1 = 10-6,4 = 3,98 10-7 =x2 / (C-x) avec C =1,36 10-5 mol / L.
x2+3,98 10-7 x -1,36 10-5 *3,98 10-7 =0.
x2+3,98 10-7 x -5,41 10-12 =0.
Discriminant D =(3,98 10-7)2 +4 *5,41 10-12 = 2,18 10-11 =(4,67 10-6)2.
Solution retenue : (-3,98 10-7 +4,67 10-6) / 2 =2,13 10-6.
pH = -log(x) ~5,67.
Le pH de l'eau passe de 4 à 5,67.
37. En déduire le principe de fonctionnement des sources pétrifiantes.
Les eaux souterraines sont sous pression et contiennent une quantité de dioxyde de carbone supérieure à celle de l'atmosphère.
A la sortie de la source, la pression diminue et une partie du dioxyde de carbone dissout se dégage.
CO2 (aq ) + CO32- + H2O =2 HCO3-
L'équilibre précédent est en conséquence déplacé vers la gauche et [CO32-] augmente
Or Ks = [Ca2+][CO32-] est constant à température constante, donc [Ca2+] diminue. (formation de CaCO3 (s)).
|
...
|
....
|
Sel et corrosion.
Pour
introduire la notion d'oxydo-réduction, l'enseignant propose de
répondre à la question suivante : " le salage des routes peut-il être
nocif pour l'environnement ? ".
Le sel peut brûler le feuillage des végétaux, déssécher les racines,
modifier les propriétés des sols ( comme leur perméabilité). Il peut
aussi par réaction chimique, libérer des métaux lourds.
La nature du contact en A fait que la droite d'action de la force de
réaction du support sur le panneau en A, notée RA est
orthogonale au panneau.
38. Donner trois intérêt à l'utilisation de ce document.
Prendre conscience des conséquences de l'utilisation du salage des routes en hiver.
Comment le sel, par réaction chimique, peut-il libérer des métaux
lourds ? Que deviennent ces métaux lourds dans l'environnement ?
Motiver les élèves pour le cours sur l'oxydo-réduction.
39. Proposer une expérience permettant la mise en évidence de l'influence de deux facteurs sur la corrosion.
Placer un clou en fer dans chacun des tubes à essais suivants :
a: tube contennt de l'air sec
b : de l'air et de l'eau distillée.
c. de l'air et de l'eau salée.
d. de l'eau bouillie recouverte d'huile ( l'eau bouillie ne contient pas de dioxygène).
40. Ecrire l'équation bilan de la réaction qui peut se produire spontanément entre les couples Fe3+ / Fe2+ et O2 / H2O en milieu neutre.
Oxydation : 2Fe2+ = 2Fe3+ +2e-.
Réduction : ½O2 +2e- + H2O =2HO-.
Ajouter et simplifier : 2Fe2+ +½O2 + H2O= 2Fe3+ +2HO-.
41. Expliquer pourquoi la présence de sel de déneigement accélère la corrosion.
Les ions chlorures déstabilisent la couche d'oxyde recouvrant le fer,
ce qui favorise la corrosion, le fer se trouvant mis à nu.
42. les tôles utilisées pour les carrosseries sont recouvertes d'une couche de zinc. Pourquoi ?
Le zinc est plus réducteur que le fer ; le zinc s'oxyde à la place du fer. Tant qu'il y a du zinc, le fer est protégé.
L'enseignant propose une évaluation contenant l'exercice suivant :
La face arrière d'un congélateur est constituée d'une plaque de fer.
Pour protéger le fer de la corrosion, un des procédés utilisés est la
galavnisation. Le dispositif est schématisé.
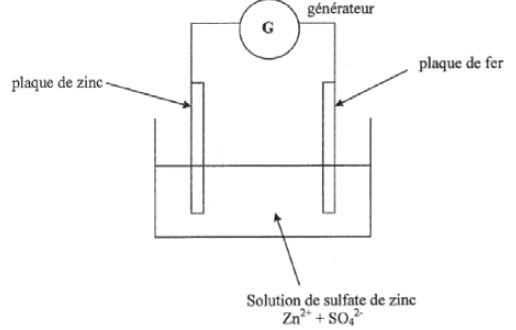
1. A quel pôle du générateur doit être relié la plaque de fer si on veut la protéger ?
2. Quel métal se dépose sur le fer ?
3. Ecrire la demi-équation électronique au niveau de la plaque de zinc. S'agit-il d'une oxydation, d'une réduction ?
4. Citer un autre moyen de protéger le fer contre la corrosion.
43. Répondre aux questions posées ci-dessus.
Le zinc doit se déposer sur le fer. L'ion Zn2+ doit être réduit au voisinage de l'électrode en fer. Celle-ci joue le rôle de cathode négative.
Le zinc se dépose sur le fer.
Zn2+ + 2e- = Zn ; réduction.
Recouvrir le fer d'une couche de peinture. Réaliser une protection anodique.
44. Calculer la masse de zinc déposée en une heure sur le fer si l'intensité du courant est 2,4 A.
Quantité d'électricité Q = I t = 2,4 x3600 =8640 C.
Quantité de matière d'électron : n = 8640 / 96500 =0,0895 mol.
Quantité de matière de zinc : 0,0895 / 2 =0,04477 mol.
M(Zn) = 65,4 g / mol ; masse de zinc : 65,4 x0,04477 ~2,9 g.
45. Cet exercice peut-il faire l'objet d'une évaluation certificative en bac pro ? Justifier.
Oui. La problématique est posée ( protection du fer contre la corrosion
) ; comprendre et analyser une situation et tirer une conclusion.
46. Compléter le diagramme potentiel-pH suivant.
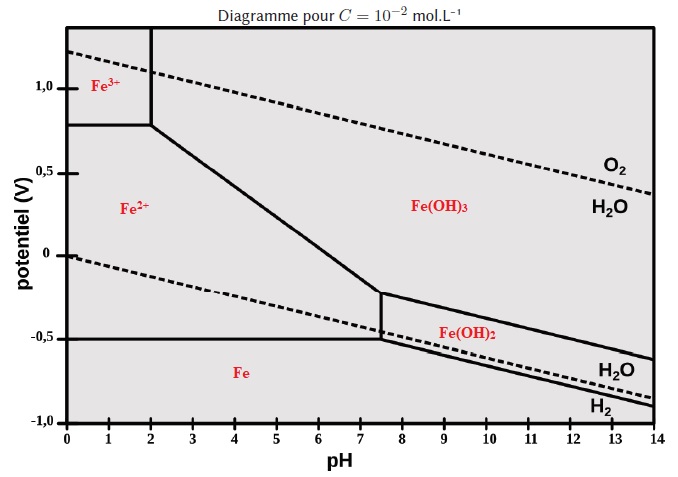
47. En prenant en
compte la précipitation de l'hydroxyde de fer (III) à partir d'une
solution de sel ferrique de concentration C = 10-2 mol/L, donner l'expression littérale et calculer le pH d'apparition de la phase solide Fe(OH)3. Ks = 10-38.
10-38= [Fe3+][HO- ]3 ; [HO- ]3 = 10-38 / 0,010 = 10-36 ; [HO- ] = 1,0 10-12 mol / L.
[H3O+] = 10-14 / [HO- ] = 1,0 10-2 mol / L ; pH = 2.
48. Sur le diagramme potentiel-pH précédent, indiquer les zones d'immunité, de corrosion et de passivation du fer.
Deux espèces ne peuvent être compatibles entre elles que si leurs
domaines de prédominance sont contigus. Si leurs domaines d'existence
sont disjoints et si elles sont mis en présence, elles réagissent entre
elles.
Zone de corrosion : l'élément fer existe sous forme Fe2+ et Fe3+.
Zone d'immunité : le métal est thermodynamiquement stable.
Zone de passivation : le fer existe sous forme d'hydroxyde Fe(OH)2 et Fe(OH)3. Encore faut-il vérifier que cette couche d' hydroxyde soit protectrice.
Le fer et l'eau apprtiennent à des domaines disjoints : en
présence d'eau le fer s'oxyde et l'eau est réduite en dihydrogène.
Fe(OH)2, Fe(OH)3 et H2O possèdent un
domaine commun : le fer est passsivé dans cette partie commune. Mais
ces hydroxydes peuvent être oxydés par le dioxygène dissous.
|
|