Récupération
des eaux de pluie. Tri des matières plastiques. Concours
CAPLP
2017.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Phénomène
de corrosion.
L'étude consiste à comparer les caractéristiques redox des métaux pour
comprendre le mauvais état d'une toiture en acier galvanisé.
D.1.1 Indiquer la
grandeur physique permettant de classer les couples redox.
Le potentiel standard d'oxydoréduction exprimé en volt.
D.1.2. Proposer une
correction de l'exercice suivant.
Les pluies acides sont responsables de la corrosion du zinc.
1. Déterminer dans ce type de corrosion les couples oxydant / réducteur
en présence. Nommer chaque espèce.
2. Ecrire la demi-équation électronique d'oxydation du zinc et celle de
réduction des ions H3O+. En déduire l'équation de
la réaction d'oxydoréduction.
3. Proposer un autre métal pour fabriquer les gouttières de façon à ne
plus avoir de corrosion.
Corrigé.
1. Ion zinc / zinc métal soit Zn2+ / Zn.
Ion oxonium / dihydrogène soit H3O+ / H2.
2. Zn = Zn2+ +2e-.
2H3O+
+2e-=
2H2O +
H2.
Zn
+ 2H3O+=
Zn2+ +2H2O
+
H2.
3. Le cuivre.
D.1.3. Qu'est-ce
qu'une pluie acide ?
Une pluie acide désigne toute forme de précipitation anormalement
acide, due à la pollution par les oxyde de soufre et d'azote.
D.1.4.
En dehors de la pollution atmosphérique, une eau de pluie a un pH
inférieur à 7. Ce caractère acide provient naturellement du dioxyde de
carbone présent dans l'air. Ecrire l'équation de la réaction du CO2
sur l'eau expliquant ce caractère acide.
CO2(aq ) +2H2O(l) = HCO3-aq
+ H3O+aq.
Etude de l'eau de pluie de pH = 4.
D. 2.1. Indiquer s'il y a eu un
phénomène de pluie acide. Justifier.
En absence de pluie acide, le pH de l'eau de pluie est un peu inférieur
à 7. A pH = 4, il y a eu un phénomène de pluie acide.
D.
2.2. Un dosage acido-basique de
cette eau doit être réalisé par les élèves. Présenter un schéma complet
et annoté de ce dosage.
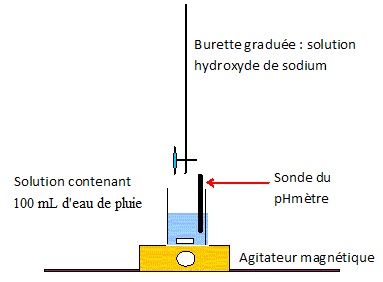
D.2.3. Préciser, en fonction du
protocole choisi, la façon de repérer l'équivalence du dosage.
Suivi pHmétrique : méthode des tangentes.
Changement de teinte de l'indicateur coloré.
D. 2.4. On
utilise 100 mL d'eau de pluie. Calculer le volume équivalent Ve pour
une solution titrante d'hydroxyde de sodium de concentration 0,01 mol /
L.
A l'équivalence : 100 x 10-4 = 0,01 Ve ; Ve = 1 mL.
D.2.5 Critiquer les
conditions expérimentales et proposer des améliorations.
Le volume équivalent doit être de l'ordre de 10 mL pour une meilleure
précision. Utiliser une solution de soude de concentration 1,0 10-3
mol / L.
D.2.6. Une
cuve de récupération d'eau de pluie contient 1000 L d'eau de pluie de
pH = 4. Une des solutions proposées est la neutralisation de l'eau
grâce à la soude caustique. Quelle sera la masse de soude à ajouter
pour que l'eau ait un pH égal à 7 ?
Calculer la masse de soude nécessaire à cette neutralisation.
Quantité de matière d'ion oxonium : 10-4 x 1000 = 0,10 mol.
Quantité de matière de soude NaOH ( M = 40 g / mol) : 0,10 mol ; masse
40 x0,10 = 4,0 g.
D.2.7. Dans le cas
d'une pluie acide due à l'acide nitrique, indiquer le nom des espèces
chimiques présentes dans le réservoir à la fin de cette opération.
Nitrate de sodium Na+ et NO3-.
Utilisation des eaux de
pluie récupérées.
L'eau de pluie est stockée dans une citerne enterrée. L'installation
d'une pompe aspirante est envisagée.
E.1.1. Expliquer
pourquoi une pompe aspirante ne peut pas aspirer de l'eau sur un
dénivelé supérieur à environ 10 m.
En aspirant de l'eau, la pompe crée une dépression dans le tuyau
d'entrée.
La pression atmoosphérique est suffisante pour pousser l'eau et combler
le vide d'air crée par la pompe tant que la hauteur est inférieure à 10
m.
E.1.2. Exposer en
quoi la construction du savoir scientifique procède par problèmes à
résoudre.
L'objectif de la démarche scientifique est d'aboutir à une conclusion
qui confirme ou infirme une hypothèse. On part de problèmes à résoudre,
pour établir des énoncés universels. La démarche expérimentale, tests
et expériences appuient la conclusion.
On
part d'une observation particulière afin de déterminer une loi : les
étapes sont des phases de questionnement et d'expériences.
E.1.3 Donner deux raisons qui
justifieraient la non utilisation du document suivant en classe.
Le baromètre :
Torricelli vit le mercure s'arrêter à 28 pouces dans un tube de
verre vertical. Cette hauteur de 28 pouces et celle de 32 pieds des
fontainiers sont dans le rapport inverse des densités de l'eau et du
mercure.
Le mercure ne peut pas être utilisé dans une expérience.
Réaliser un baromètre à eau est quasiment impossible, vu la hauteur du
tuyau vertical, une dizaine de mètres, fermé à l'extrémité supérieure.
E.1.4. Déterminer
l'énergie nécessaire pour remonter de la citerne une masse d'eau d'une
hauteur H.
Débit : d m3 s-1 ; r masse volumisur kg m-3
; t : durée en seconde ; masse d'eau : m =d t r .
Energie E = m g H = d
t r g H.
E.1.5. En déduire
la puissance mécanique.
Pméc = E / t = d
r g H.
E.1.6. Calculer
cette puissance si d = 2500 L / h et H = 9 m.
d = 2,5 /
3600 = 6,94 10-4 m3/s ;Pméc=6,94 10-4
x1000 x9,8 x9 ~ 61 W.
E.1.7 La
puissance électrique consommée par la pompe est 250 W. Calculer le
rendement. Indiquer ce qui a été négligé dans les question précédentes
pour expliquer ce faible rendement.
61 / 250 ~0,24.
Le fluide n'est pas immobile. Il faut utiliser la relation de Bernoulli.
Etude
électrique.
Ce
moteur est électrique et peut être assimilé en première approche à une
inductance associée en série à une résistance électrique. le facteur de
puissance est cos j
= 0,80. Il est branché sur le secteur ERDF.
E.2.1.
En déduire la
puissance réactive et la puissance apparente de cette installation de
pompage.
P = 250 V ; P = UI cos j
; puissance apparente S = UI = 250 / 0,8 =312,5 ~313 VA ;
Puissance réactive Q = UI sin j
= 312,5 x 0,6 =187,5 ~187 var.
E.2.2. Déterminer l'intensité du
courant.
I = S / U = 312,5 / 230 =1,36 ~1,4 A.
Modélisation expérimentale.
On utilise en classe un petit moteur électrique, alimenté par un
générateur de basses fréquences ( signal sinusoïdal, 12 V efficace, 50
Hz ). L'oscillogramme a permis d'enregistrer la tension u(t) aux
bornes du GBF et la tension v(t) aux bornes du moteur et
proportionnelle à i(t).
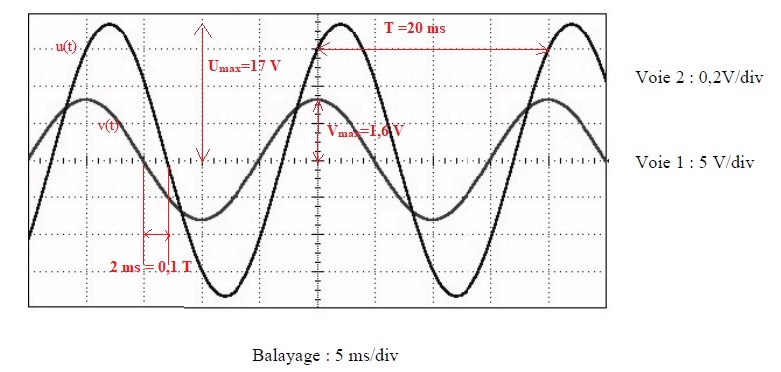
E.3.1.
Vérifier que la fréquence est bien 50 Hz et identifier u(t) et v(t) en
justifiant.
T = 20 ms = 0,020 s ; f = 1
/0,020 =50 Hz.
U max = 12 / 0,707 ~ 17 V. V max =1,6 V.
E.3.2. Montrer qu'une valeur du
facteur de puissance de 0,80 est compatible avec l'oscillogramme.
0,1 T correspond à 360 x0,1 = 36 °.
cos 36 ~0,80.
|
...
|
....
|
Le polystyrène.
F.1.1 Définir le
terme "polymère".
Un polymère est une macromolécule constituée de la répétition de
nombreux sous unités ( monomères).
F.1.2. Le styrène
est un composé organique aromatique de formule brute C8H8.
Définir, du point de vue terminologie chimique, l'adjectif "
aromatique".
Les composés aromatiques sont constitués d'un ou plusieurs cycles,
formant une structure plane, comportant 4 n+2 électrons délocalisés sur
l'ensemble du cycle. Ces molécules sont très stables.
F.1.3.
En déduire l'écriture de la formule du polystyrène.
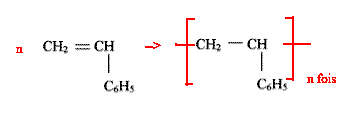
F.1.4. La masse molaire du
polystyrène étant de 155 kg / mol, calculer le degré de polymérisation
du styrène.
155 103 / M(styrène) = 155 103 / 104 =1490.
F. 1.5. Préciser à quelle famille
appartient le pentane et donner sa formule brute.
Famille des alcanes ; C5H12.
F.
1.6. Ecrire les formules
semi-développées et les nommer.

Les
matières plastiques peuvent être recyclées ?
F.2.1. Indiquer ce qui caractérise
un thermodurcissable et d'un thermoplastique.
Thermoplastique :
matière qui se ramollit d'une façon répétée lorsqu'elle est chauffée
au-dessus d'une certaine température, mais qui, au-dessous, redevient
dure. Une telle matière conservera de manière réversible sa
thermoplasticité initiale.
Thermodurcissable :
il ne peut être mis en œuvre qu'une seule fois et devient infusible et
insoluble après polymérisation. Une fois durci, sa forme ne peut plus
être modifiée ; ils ont une structure tri dimensionnelle.
F. 2.3. Indiquer
les dangers pour l'environnement et la santé du "brûlage" du PVC.
Le brûlage du PVC émet de l'acide chlorhydrique, des dioxines et des
furanes.
Les dioxines s'accumulent dans la chaine alimentaire ; toxiques elles
peuvent conduire à des cancers.
Les furanes provoquent des dommages au foie.
F.2.4
Indiquer les réponses attendues aux questions suivantes.
L'étude porte sur trois échantillons de matières plastiques :
échantillon 1 : chevilles plastiques ; échantillon 2 : prises
électriques ; échantillon 3 : canalisations.
Indiquer le test à
réaliser afin d'identifier, parmi ces échantillons, les matériaux
recyclables.
Seules les matières thermoplastiques peuvent être recyclées par fusion
et moulage.
Les chevilles plastiques sont en polypropylène, thermoplastique, donc
recyclable.
Les prises électriques sont en polyamide ; sous l'effet de la chaleur,
ils ne se ramollissent pas mais passe rapidement de l'état solide à
l'état liquide.
Les canalisations sont en polyéthylènes ; thermoplastiques, donc
recyclables.
Test de chauffage
: chauffer l'agitateur en verre tenu avec une pince en bois dans la
flamme de la lampe à alcool et le poser sur l'échantillon. Si
l'échantillon se ramollit (ou garde une empreinte) le test est positif
: le plastique est un thermoplastique.
Test de densité : plonger l'échantillon dans un becher rempli d'eau et le maintenir immergé durant 20 s, puis le libérer.
Si l'échantillon surnage, le test est positif : densité inférieure à 1.
Test de Belstein
: chauffer au rouge un fil de cuivre tenu à l'aide d'une pince en bois.
Poser le fil sur l'échantillon et le tourner pour l'enrober de
plastique. Réintroduire ce fil au sommet de la flamme du bec Bunsen. Si
la flamme devient verte, le test est positif ; présence de chlore dans
le plastique.
Test du sovant : placer l'échantillon dans un tube à essais ; y verser 2 mL d'acétone prélevés à l'aide d'une pipette.
Attendre 10 minutes et verser quelques gouttes d'eau distillée dans le tube. Si un précipité apparaît le test est positif.
Test de rétractation : ploner l'échantillon dans de l'eau bouillante en le tenant avec une pince. Si l'échantillon se rétracte, le test est positif.
|
|



