Le
rôle métabolique de l'ATP, titrage des ions Ca2+ et Mg2+,
Capes physique chimie 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Le rôle
métabolique de l'ATP.
L’ion noté ATP4−,
résultant de la combinaison d’un groupe triphosphate et d’un nucléoside
issu d’un résidu d’adénine, est la forme complètement déprotonée de
l’ATP (encore notée H4ATP). Sa structure chimique est
représentée.
Les courbes de distribution de différentes formes de l'ATP en
fonction du pH, notées respectivement ATP4−, HATP3−,
et H2ATP2−, de la plus déprotonée à la moins
déprotonée des espèces sont représentées.
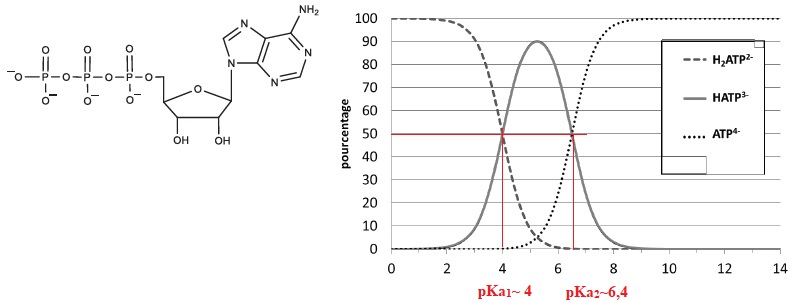
Q14.
En exploitant les figures, donner les valeurs des pKa associés aux
différents couples de l’ATP à 25 °C. En déduire la forme ou les formes
sous lesquelles l’ATP se trouve principalement dans le sang (pH = 7,4).
A pH=7,4 supérieur à pKa2 =6,4, la forme ATP4−prédomine
( 90 %).
Une
grande partie
de l’énergie libérée par les processus biologiques impliquant de l’ATP
provient de la rupture de la liaison phospho-anhydride entre les
différents groupements phosphate produisant l’adénosine diphosphate,
notée ADP3−, selon l’équilibre présenté dans la Figure 10.
Cette réaction est étudiée à la température T = 310 K pour laquelle
l’enthalpie libre standard de réaction associé est égale à DrG° = – 30,5
kJ.mol-1.
ATP4−(aq)+2H2O(ℓ)=ADP3−(aq)+HPO42−(aq)+H3O+.
Q15.
Calculer la constante d’équilibre associée à la transformation chimique
de l’ion ATP4− en ion ADP3− à 310 K.
DrG° = -RT ln
K ; ln K = 30,5 103 /(8,314 x310) =11,83 ; K = 1,38 105.
Durant les premiers instants de l’effort, la consommation d’ATP est
importante et la régénération des stocks doit être assurée par des
processus rapides. L’équilibre de phosphorylation de la créatine
participe à la régulation des concentrations en ions ATP4−et
d’ADP3− selon le bilan représenté dans la Figure 11. Cette
réaction est catalysée par une enzyme, la créatine kinase. La constante
d’équilibre associée à la réaction est K° = 4,8. 10−2 à 310
K.
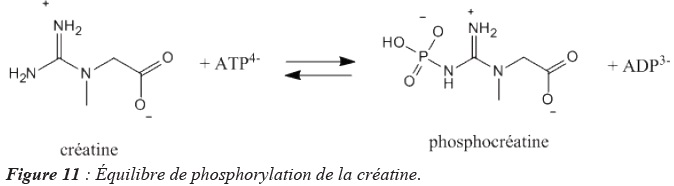
Q16. Au cours d’un
effort musculaire intense, les concentrations cellulaires sont de
l’ordre de [ATP4−] = 1,0. 10−4 mol. L−1
et [ADP3−] = 5,0. 10−1 mol. L−1 et le
rapport [phosphocréatine] / [créatine] = 0,10. À l’aide de ces
informations, prévoir le sens
d’évolution du système et conclure.
Quotient de réaction Q =[phosphocréatine]
[ADP3−]
/
([créatine]
[ATP4−] )
Q = 0,10 x 0,50 / (1,0 10-4) =5,0 102.
Q >> K°, la réaction s'effectue dans le sens indirect, formation
de ATP4−.
Q17. Résolution de
problème.
En milieu aérobie (présence de dioxygène), la dégradation du glucose,
de formule brute C6H12O6,
produit du dioxyde de carbone et de l’eau lors de la respiration
cellulaire. Lorsque l'intensité de l'effort est maximale, la
consommation de dioxygène atteint une valeur seuil appelée VO2,max
mesurée en mL.min-1.kg-1. L'effort ne peut être
maintenu au-delà de quelques minutes à des intensités d’effort
correspondant à la valeur VO2,max . Pour le sportif,
connaitre et améliorer sa valeur VO2,max est indispensable à
la gestion de la performance.
Dans la Figure 12 sont présentées les données d’une étude scientifique
réalisée sur un tennisman de niveau international de masse égale à 90
kg. Les données indiquent le volume de dioxygène VO2
consommé en fonction de l’intensité de l’effort, évalué ici par une
cadence croissante du nombre de balles à frapper alternativement en
coup droit et en revers, jusqu’au maximum.
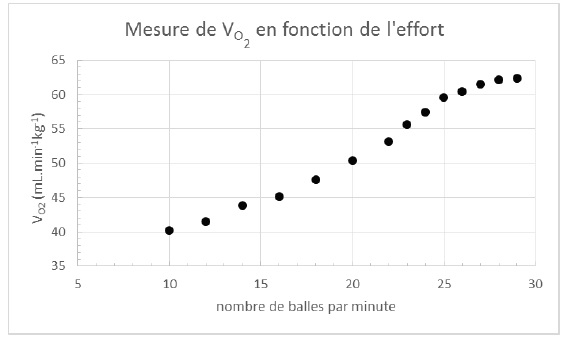
Déterminer le nombre de barres énergétiques, représentant chacune un
apport de 147 kcal/barre, que devrait consommer le sportif pour
compenser totalement les pertes énergétiques occasionnées par un effort
d’une heure à 80% de son seuil VO2,max à une température
extérieure de 25°C. On suppose dans cette étude que l’enthalpie
standard de la réaction de dégradation du glucose en dioxyde de carbone
et en eau lors de la respiration cellulaire est indépendante de la
température.
Réaction de respiration cellulaire :
C6H12O6 aq + 6 O2aq -->
6H2O(l) + 6 CO2 aq.
Enthalpie :DH r°
= 6DH f°(CO 2(g))
+ 6 DH f°(H 2O(l))
- DH f°(C 6H 120 6(s))
- 6 DH f°(O 2(g))
DHr° = 6*(-393,5) + 6 (-285,1) -
(-1273,3) ~ -2798 kJ/mol.
Volume
de dioxygène consommé durant un effort d'une heure à 80 % de VO2
max :
0,80 x 63 x60 x90 =2,72 105 mL ~ 0,27 m3.
Quantité de matière correspondante : n = 0,272 / 0,0248 = 10,97 ~ 11
mol.
Quantité de matière de glucose consommé : n / 6 =10,97 / 6 ~1,83 mol.
Energie correspondante : 2798 x 1,83 ~5,11 103 kJ. (1,22 103
kcal)
Nombre de barres : 1,22 103 / 147 ~8,3 soit 9 barres.
|
|
....
|
3) Compenser les pertes dues à l’effort.
Au cours de l’effort, il est nécessaire de boire régulièrement pour
compenser la perte d’eau et minéraux par transpiration, et éviter la
déshydratation. Si de nombreux produits d’alimentation spécifiques sont
désormais proposés au public, beaucoup de sportifs choisissent de
préparer eux-mêmes leurs ravitaillements. Un exemple de recette est
donné ci-dessous. Afin de s’hydrater correctement, il est conseillé
d’utiliser des eaux pétillantes, riches en minéraux, notamment en
sodium, magnésium et calcium.
« Pour préparer une boisson isotonique d'effort de longue durée, versez
30 à 40 g de maltodextrine dans 1 litre d'eau minérale, si possible
gazeuse. Ajoutez 30 g de sucre (saccharose). Ajoutez une pincée de sel
(une pincée correspond à une cuillère à café rase soit environ 1 g de
sel) et un demi-citron pressé. Conservez au frais et consommez dans les
24 heures. »
Dans le cadre de l’enseignement de spécialité Sciences Physiques et
Chimiques en Laboratoire (SPCL) en terminale Sciences et Technologies
de Laboratoire (STL), un professeur souhaite proposer une activité de
laboratoire sur le titrage des ions calcium et magnésium dans l’eau. Il
s’appuie sur le document fourni dans l’Annexe 2. L’objectif de cette
séance expérimentale est de développer l’autonomie des élèves via une
démarche d’investigation. Le protocole proposé est appliqué au dosage
de l’eau minérale utilisée pour préparer la boisson de
la recette. Les volumes à l’équivalence obtenus lors des deux titrages
sont respectivement VE1 = 14,2 mL et VE2 = 15,3
mL. L’étiquette indique que l’eau testée contient 80 mg. L−1
d’ions magnésium et 153 mg. L−1 d’ions calcium.
Q18. Proposer une
partie d’activité (deux questions maximum) permettant de faire
travailler la compétence « VALIDER » aux élèves. Le questionnement
ainsi que les informations apportées aux élèves pour traiter les
questions posées seront détaillés.
- Proposer un encadrement des volumes équivalents à partir des
incertitudes.
- En déduire un encadrement des concentrations en ion Ca2+
et Mg2+. Comparer aux indications de l'étiquette.
Documents à fournir :
Indiquer les réactions support des titrages de ces ions ainsi que les
formules permettant de calculer leurs concentrations massiques.
Donner la formule permettant de calculer l'incertitude.
Des calculs d’incertitudes sur le titrage effectué ont été réalisés.
Les incertitudes-types suivantes sur la concentration en masse en
calcium et la concentration en masse en magnésium sont obtenues :
u(CMg) = 7 × 10−3 g. L−1 et u(CCa) = 5 × 10−3
g. L−1.
a) Titrage global des ions calcium et magnésium.
Le titrage global des ions calcium et magnésium est réalisé en milieu
tamponné à pH = 10.
- Introduire dans un erlenmeyer une prise d’essai de 10,0 mL d’eau
minérale à doser.
- Ajouter environ 20 mL de tampon ammoniacal et une pointe de spatule
de NET.
- Tiédir l’ensemble sur plaque chauffante sous agitation.
- Remplir la burette avec une solution d’EDTA de concentration en
quantité de matière CEDTA = 5,00×10−3 mol.L−1.
- Réaliser le titrage, on notera VE1 le volume de solution
titrante versé à l’équivalence.
b) Titrage sélectif des ions calcium.
Le titrage sélectif des ions calcium est réalisé en milieu basique.
- Introduire dans un erlenmeyer une prise d’essai de 20,0 mL d’eau
minérale à doser.
- Ajouter environ 2 mL d’une solution d’hydroxyde de sodium de
concentration en quantité de matière égale à 4 mol.L-1, 40
mL d’eau distillée et une pointe de spatule du réactif de Patton et
Reader.
- Remplir la burette avec une solution d’EDTA de concentration en
quantité de matière CEDTA = 5,00×10−3 mol.L−1.
- Réaliser le titrage, on notera VE2 le volume de solution
titrante versé à l’équivalence.
Q19. Comparer les
résultats du dosage aux valeurs indiquées sur l’étiquette de la
bouteille d’eau minérale, conclure et commenter les résultats obtenus.
Mg2+aq + Y4-aq --> YMg2- ;
Ca2+aq + Y4-aq
--> YCa2- .
[Ca2+] =[Y4-
]x VE2
/ Veau =5,00 10-3 x15,3 / 20,0
=3,825 10-3 mol / L
[Mg2+] +[Ca2+]
=[Y4- ]x VE1
/ Veau =5,00 10-3 x14,2 / 10,0 =7,1 10-3
mol / L
[Mg2+] =
(7,1-3,825) 10-3 =3,275
10-3 mol / L.
Concentrations massiques :
c(Mg2+) = [Mg2+]
x M(Mg) =3,275 10-3 x24,3 ~ 79,6
10-3 g / L ou 79,6 mg / L.
c(Ca2+) = [Ca2+]
x M(Ca) =3,825 10-3 x 40,1
~ 153 10-3 g / L
ou 153 mg / L.
Prendre en compte les incertitudes :
c(Mg2+) =(80 ±7
)mg/ L ; c(Ca2+) =(153±5)
mg / L.
Résultats en accord avec les indications de l'étiquette.
Q20. Déterminer la gamme de pH pour
laquelle les ions calcium peuvent être titrés sélectivement.
L’équivalence est repérée par un changement de couleur.
Ca(OH)2 s --> Ca2+aq + 2HO-aq.
Ks = [Ca2+aq] [HO-aq] 2
= 10-5,3.
[HO-aq] 2
= 10-5,3 / (3,825 10-3) =1,31 10-3 ;
[HO-aq]
=3,62 10-2 mol / L.
pH =14+log(3,62 10-2) =12,6.
L'hydroxyde de calcium précipite à pH > 12,6.
Recherche du pH à partir duquel 99 % des ions magnésium sont précipités sous forme d'hydroxyde de magnésium :
[Mg2+aq] résiduel = 3,275 10-3 / 100 =3,275 10-5 mol / L.
Mg(OH)2 s -->
Mg2+aq + 2HO-aq.
Ks = [Mg2+aq] [HO-aq] 2
= 10-10,8.
[HO-aq] 2
= 10-10,8 / (3,275 10-5) =4,84 10-7 ;
[HO-aq]
=6,95 10-4 mol / L.
pHmini =14+log(6,95 10-4) =10,84.
Pour doser les ions calciium seul, il faut un pH compris entre 10,8
< pH < 12,6.
Q21. Indiquer la couleur du milieu
réactionnel avant et après l’équivalence dans chacun des dosages
réalisés. Expliquer l’évolution de
la couleur des solutions titrées au cours des deux dosages.
Dosage des ions
magnésium :
Avant l'équivalence, les ions Mg2+ forment avec le NET un
complexe de couleur rouge
vin.
Après l'équivalence, le NET donne à la solution une teinte bleue à pH =
10.
Dosage des ions calcium :
Avant l'équivalence, les ions Ca2+ forment avec le réactif
de Patton un complexe de couleur rose
violet.
Après l'équivalence, le réactif de Patton donne à la solution une
teinte bleue à pH = 10.
|
|


