Physique
chimie, le chitosane pour pièger les métaux lourds.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
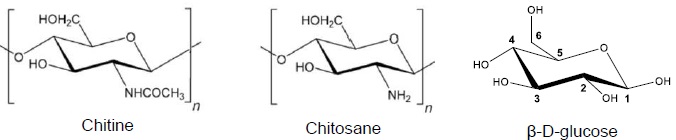
La
chitine est l’un des constituants principaux de l’exosquelette des
crustacés, des animaux à coquilles et des insectes. Elle est le
deuxième polysaccharide le plus répandu dans la nature, après la
cellulose. Cependant, la chitine est soluble dans très peu de solvants,
ce qui limite ses applications. C’est pourquoi, on la transforme
chimiquement en chitosane.
Ce polymère biodégradable et biocompatible offre de nombreuses
possibilités dans les domaines pharmaceutique, biomédical,
agroalimentaire et environnemental.
A. Le chitosane pour piéger les métaux lourds.
Les propriétés complexantes du chitosane sont étudiées pour extraire des métaux lourds d’eaux polluées.
Q16. Quelles sont les fonctions chimiques présentes dans la chitine et dans le chitosane?
Identifier les sites bases de Lewis qui peuvent complexer un métal.
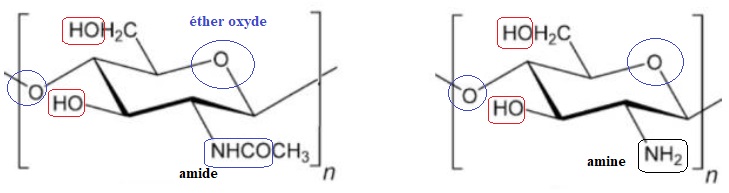
Les fonctions entourées ci-dessus possèdent des atomes d'oxygène et
d'azote, porteurs de doublets non liants et sont donc des bases de
lewis.
Q17. Le monomère du
chitosane est une glucosamine, un glucide de la famille des osamines
dont la structure est fondée sur celle du β-D-glucose.
a) Représenter la
formule semi-développée de la forme ouverte du β-D-glucose, puis en
déduire si le β-D-glucose est un aldose ou un cétose.
b) Représenter en
projection de Fischer la forme ouverte du β-D-glucose. Que désigne la
lettre D dans la dénomination « β-D-glucose » ?
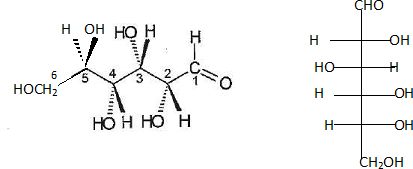
Le β-D-glucose est un aldose, présence d'une fonction aldehyde.
D "dextrogyre" : propriété d'une
molécule de faire dévier le plan de
polarisation de la lumière polarisée vers la
droite.
Q18.
On dispose de 60 g de carapaces de crevettes. Cette masse de carapaces
est-elle suffisante pour ramener 40 mL d’une solution de sulfate de
cuivre de concentration initiale égale à 0,1 mol.L–1 aux
normes environnementales françaises de pollution des eaux en cuivre (
0,5 mg / L)? Si non, quelle est la masse minimale de carapaces de
crevettes nécessaires pour éliminer le cuivre de la solution ?
100 g de carapaces de crevettes conduisent à 4 g de chitosane.
60 g de carapaces de crevettes conduisent à 2,4 g de chitosane.
Évolution du rapport d’absorbance A/A0 (donné en %) en fonction de la masse de chitosane ajoutée pour 40,0 mL de solution aqueuse à la concentration initiale C0 = 0,1 mol.L–1. L’absorbance de la solution initiale a pour valeur A0 = 1,26.
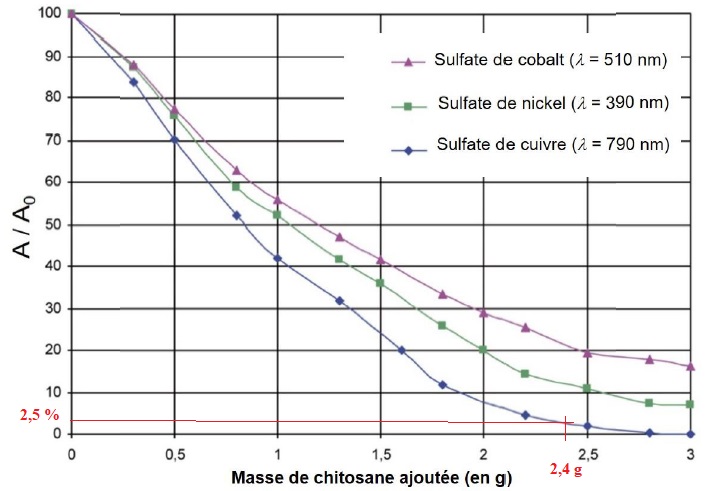
Concentration de la solution de sulfate de cuivre après traitement : 0,1 *0,025 =2,5 10-3 mol / L.
Concentration massique en cuivre : 2,5 10-3 * 65,4 ~0,16 g / L, valeur supérieure à 5 mg / L, seuil réglementaire.
Il faut 3 g de chitosane soit 3 *100 /4 = 75 g de carapaces de crevettes pour éliminer tout le cuivre de la solution.
Q19. Proposer une explication de la solubilité du chitosane dans l’eau, en conditions acides.
Les fonctions amine et amide sont protonées. Des interactions
électrostatiques se crééent entre les molécules d'eau et ces fonctions.
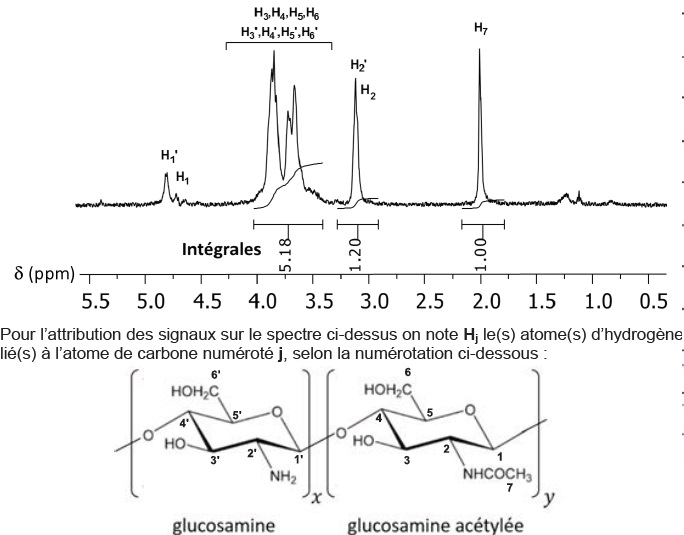
La spectroscopie de RMN 1H est une technique d’analyse simple
permettant d’évaluer le degré d’acétylation DA d’un chitosane. On donne
un extrait du spectre RMN 1H 500 MHz réalisé lors de l’étude d’un
polymère de chitine issu d’une réaction de désacétylation.
Q20. Expliciter ce que désigne la fréquence « 500 MHz » du spectre RMN 1H ?
Il s'agit de la fréquence de résonance ( fréquence de larmor ) proportionnelle à l'intensité du champ magnétique créé.
Q21. En vous
appuyant sur l’exemple de la molécule d’éthanol dont le spectre serait
enregistré à l’aide du même spectromètre RMN, expliquer les notions
d’intégration d’un signal et de multiplicité spectrale. Préciser la
multiplicité spectrale attendue pour le
signal de l’atome hydrogène porté par l’atome de carbone numéroté 1 du
β-D-glucose . Préciser la multiplicité spectrale attendue pour le
signal de l’atome hydrogène porté par l’atome de carbone numéroté 2 du
β-D-glucose.
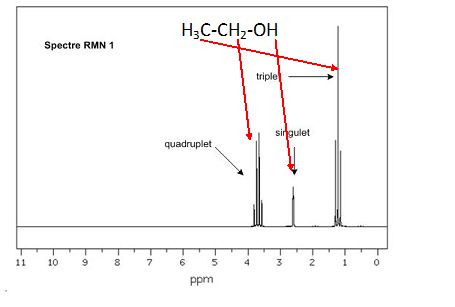
CH3
: ces protons équivalents ont 2 protons proches voisins, on observe un
triplet. Multiplicité = 3 et intégration I = 3.
CH2 : ces protons équivalents ont 3 protons proches voisins,
on observe un quadruplet. Multiplicité = 4 et intégration I = 2.
OH : ce proton n'a aucun proton proche voisin, on observe un singulet. Multiplicité = 1 et intégration I = 1.
Le signal de l’atome hydrogène porté par l’atome de carbone numéroté 1 du
β-D-glucose est un doublet, multiplicité = 2 et intégration I = 1. ( l'atome de carbone 2 porte un hydrogène).
Le signal de l’atome hydrogène porté par l’atome de carbone numéroté 2 du
β-D-glucose est un triblet, multiplicité = 3 et intégration I = 1. ( les atomes de carbone 1 et 3 portent chacun un hydrogène).
Q22.
Proposer un argument pour expliquer que le signal du groupement méthyle
de la partie « glucosamine acétylée » du chitosane analysé est un
singulet.
L'atome de carbone voisin ne porte pas d'atomes d'hydrogène.
Q23. Déterminer le degré d’acétylation (DA) du chitosane analysé. Commenter la qualité de cette détermination expérimentale.
L'intensité d'un pic est proportionnelle au nombre de protons qui en est la cause.
Le pic H7 est uniquement présent dans le chitosane acétylé. Il intègre pour une valeure de 1,00.
Le pic H2 et H2' est présent dans le glycosamine et dans le glucosamine acéthylé. Il intègre pour une valeur de 1,2.
Les protons H3 à H6 intègrent pour une valeur de 5,18.
Les 5 protons communs aux deux molécules intègrent pour une valeur de 1,2 +5,18 = 6,38.
Intégration moyenne d'un proton : 6,38 / 5 =1,276
Proportion de glucosamine acéthylée : 1,00 / 1,276 ~0,78 ( 78 %).
|
...
|
....
|
C. Des associations fructueuses.
Le chitosane est associé à d’autres substances afin de créer des
gels, des films, des billes, etc. aux propriétés nouvelles. Par
exemple, des recherches visent à fabriquer des nanoparticules de
maghémite 𝛾-Fe2O3 encapsulées dans du chitosane
et capables d’extraire le chrome (VI) d’eaux polluées. Ces billes
millimétriques de chitosane sont ensuite séparables des eaux à
dépolluer par leurs propriétés magnétiques provenant de la maghémite.
Q24. Quelques-uns des résultats d’une équipe de recherche sont fournis. À partir de ce dernier, déterminer l’enthalpie standard DrH° et l’entropie standard DrS°
associées à la fixation du chrome à la surface des billes de chitosane
fabriquées. Commenter le signe de chacune des valeurs obtenues.
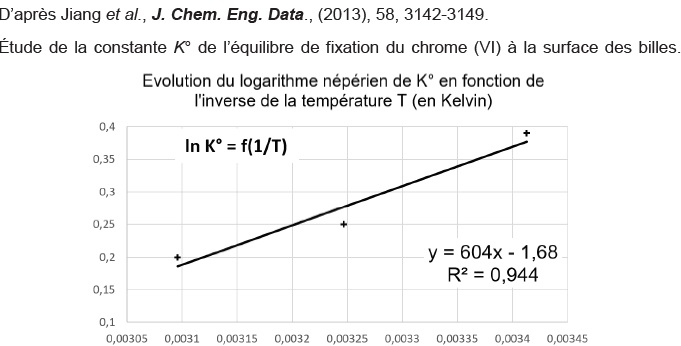
DrG° = DrH° -TDrS°et DrG° = -RT ln K°.
ln K° = DrS° / R -DrH° / R * 1 / T.
On identifie : DrS° / R = -1,68 soit DrS° = -1,68 *8,31 ~-14 J K-1 mol-1.
L'entropie étant négative, le désordre diminue lors de cette réaction.
-DrH° / R =604 ; -DrH° = -604 *8,31 ~ -5,0 103 J mol-1.
La réaction est exothermique.
Une
autre voie explorée concerne les Liquides Ioniques (LI). Ce sont des
systèmes ioniques particuliers dont les propriétés physico-chimiques
spécifiques pourraient permettre de remplacer les solvants organiques
volatils dans de nombreux domaines. En les associant au chitosane, des
chercheurs proposent un procédé efficace et réversible pour extraire le
dioxyde de carbone d’effluents gazeux afin d’éviter ses conséquences
néfastes sur l’environnement. Dans le cadre des projets réalisés par
les élèves pendant l’année de Terminale STL, spécialité SPCL, un groupe
d’élèves travaille sur les propriétés du chitosane. Ils interrogent
alors leur professeur car ils ne comprennent pas une figure issue de
leur recherche bibliographique représentant un spectre infrarouge
acquis par un spectromètre à Transformation de Fourier et équipé d’un
module de Réflexion Totale Atténuée ou ATR.
Leur première interrogation concerne l’allure des spectres
infrarouges ayant des « bandes qui pointent vers le haut »
contrairement aux spectres étudiés en classe qui ont des « bandes qui
pointent vers le bas » ;
leur seconde interrogation concerne le détail du mécanisme
réactionnel de fixation du dioxyde de carbone sur le chitosane car
celui-ci n’est pas explicité sur la figure.
Q25. Définir la grandeur « Absorbance ».
Absorbance = A = log ( intensité incidente / intensité qui travers l'échantillon).
Q26. Proposer à ce
groupe d’élèves une réponse scientifique à chacune de leurs deux
interrogations, en précisant notamment l’intérêt analytique d’acquérir
le signal infrarouge en absorbance.
L'axe des ordonnées est gradué en absorbance et non pas en transmitance T.
A = -log ( T).
On obtient ainsi des pics bien définis plutôt que les larges bandes observées en transmitance.
Le dioxyde de carbone électrophile se fixe sur l'atome de carbone nucléophile : substitution électrophile.
Q27. Citer un avantage lié à l’acquisition de spectres infrarouges par Transformation de Fourier.
Mesures prises rapidement et meilleure résolution.
|
|