Protection
par voie électrochimique des hublots immergés en milieu marin vis à vis
des sallissures.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Les
éléments optiques en milieu marin se recouvrent progressivement de
micro-organismes. Ces derniers sont à l'origine de problèmes tels
que blocage des fonctions mécaniques, perte des propriétés optiques,
accélération de la corrosion. Jusqu'à maintenant, la technique de
nettoyage mécanique avec intervention humaine était utilisée. Une autre
voie est désormais envisagée : la production d'eau de Javel par
électrolyse de l'eau de mer.
Une concentration en eau de Javel supérieure à 3,0 10-4 mol / L suffit à détruire ces micro-organismes. Cette concentration étant faible, elle n'aura pas d'impact sur l'environnement.
L'étude suivante porte sur la production d'eau de Javel dans une eau
proche des côtes atlantiques. La température moyenne est de 14°C. La
production étant liée aux ions chlorures, la première partie consiste à
les doser. Puis l'électrolyse est menée à une température constante
afin de déterminer son rendement.
Dosage des ions chlorures dans l'eau de mer.
Mode opératoire.
L'eau de mer prélevée est diluée d'un facteur 10. Une prise
d'essai E = 10,0 mL, de cette eau diluée est dosée par une
solution de nitrate d'argent de concentration C = 5,00 10-2
mol / L en présence de quelques gouttes d'une solution aqueuse de
chromate de potassium à la concentration molaire de 0,2 mol / L.
L'équivalence est repérée par un changement de couleur.
Afin d'effectuer une mesure statistique, le dosage est effectué 18 fois. Les volumes relevés à l'équivalence sont donnés :
VE(mL)
|
11,60
|
11,65
|
11,60
|
11,70
|
11,80
|
12,00
|
12,05
|
11,95
|
11,70
|
| VE(mL) |
11,90
|
11,85
|
11,75
|
11,90
|
11,95
|
12,05
|
11,80
|
11,90
|
11,95
|
1. Ecrire l'équation de la réaction support du titrage et déterminer la concentration en ion chlorure.
Ag+aq + Cl-aq ---> AgCl(s).
A l'équivalence, n(Cl-)= n(Ag+) = C VE.
[Cl- ] E = C VE ; [Cl- ] = C VE / E = 5,00 10-2 VE / 10,00 =5,00 10-3 VE.
Valeur moyenne de VE =11,84 mL.
[Cl- ] = 5,00 10-3 x 11,84 =0,0592 mol/ L.
Ecart type : s = 0,176 ;
Incertitude U( [VE ] )=2,1 s / n½ = 2,1 x0,176 / 18½ =0,087.
DC(Cl-)=5 10-3 U( [VE ] )=5 10-3 x0,087~4 10-4.
[Cl- ] = 0,0592 ±4 10-4 mol/ L.
Tenir compte de la dilution : [Cl- ] =0,592 ±4 10-3 mol / L.
2. Jxpliquer le rôle du chromate de potassium. Justifier quantitativement les apparitions successives de différents précipités.
On donne Ks(AgCl )= 10-9,7 ; Ks(Ag2CrO4)=10-12.
Le chlorure d'argent commence à précipiter dès que : [Ag+aq] [Cl-aq] = 10-9,7.
[Ag+aq]= 10-9,7 / [Cl-aq] =10-9,7 / 0,59 ~3,4 10-10 mol/L.
Le chromate d'argent commence à précipiter dès que : [Ag+aq]2 [CrO42-aq] = 10-12.
[Ag+aq]= (10-12 / [CrO42-aq])½ =(10-12 / 0,2 )½ ~2,2 10-6 mol/L.
Le chlorure d'argent prècipite dès que [Ag+aq]=1,0 10-10 mol/L tandis que le chromate d'argent n'apparaît que lorsque [Ag+aq]=2,5 10-6 mol/L . AgCl(s) apparaît le premier ( formation d'un précipité blanc).
Lorsqu'il n'y a plus d'ion chlorure, les ions argent réagissent avec l'ion chromate ( formation d'un précipité rouge).
L'ion chromate joue le rôle d'indicateur de fin de réaction.
|
....
|
Etude quantitative de l'électrolyse.
Il
s'agit d'oxyder électrochimiquement les ions chlorure présents dans
l'eau de mer pour produire du chlore actif sous forme d'ion
hypochlorite ClO-, à la surface même de la surface à
protéger. L'électrolyse de l'eau de mer est réalisée à l'aide de deux
électrodes de platine auxquelles est appliquée une tension de 9,0 V et
une intensité de 58 mA pendant une durée de 13 minutes. Pour une
température de 14°C, le volume de gaz recueilli à la cathode est de 5,0
mL à la pression atmosphérique patm = 1,013 105 Pa.
2.
Donner la structure de Lewis de l'acide conjugué de l'ion hypochloryte. L'angle de valence est de 102,1°. Justifier.
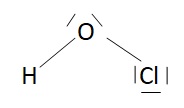
L'angle de valence est inférieur à 109,5° du fait de la répulsion des doublets non liants de l'atome d'oxygène.
3. Ecrire
les équations des réactions électrochimiques susceptibles de se
produire à l'anode d'une part et à la cathode d'autre part.
Oxydation de l'eau et de l'ion chlorure à l'anode.
H2O (l)--> ½O2(g) + 2H+aq + 2e-.
Cl-aq +H2O (l)--> ClO-aq + 2H+aq + 2e-.
ou 2 Cl-aq --> Cl2(g) + 2e-.
Réduction de l'eau ou de Na+ à la cathode :
2H2O (l) + 2e---> H2(g) + 2HO-aq .
Na+aq +e- = Na(s)
3.
On observe un dégagement de dichlore à l'anode, l'oxydation de l'eau
étant lente et celle des ion chlorure rapide. Donner l'équation de la
réaction d'électrolyse et justifier la formation d'eau de Javel.
2 Cl-aq --> Cl2(g) + 2e-.
2H2O (l) + 2e---> H2(g) + 2HO-aq .
2H2O (l) + 2Cl-aq--> H2(g) + 2HO-aq +Cl2(g).
Le pH de l'eau de mer est compris entre 7 et 8. En milieu basique le dichlore se dismute selon :
2HO-aq +Cl2(g) -->Cl-aq + ClO-aq +H2O(l).
4. Déterminer le rendement de l'électrolyse dans ces conditions opératoires.
Quantité de matière de dichlore assimilé à un gaz parfait :
n = PV / (RT) =5,0 10-6 x1,013 105 /(8,314 x(273+14))=2,12 10-4 mol.
n(e-) = 2 n =4,24 10-4 mol.
Quantité de charge expérimentale : n(e-) F = 4,24 10-4 x96500 ~41 C.
Quantité de charge rhéorique : Q = I t = 0,058 x13 x60 ~45 C.
Rendement : 41 / 45 ~0,91 (91 %).
Les
électrodes doivent être assez volumineuses pour assurer une électrolyse
pendant une durée assez longue et résister aux conditions du milieu
marin. Le matériau choisi doit donc être peu sensible à la corrosion
provoquée par l'eau de mer. Ces électrodes sont composées de dioxyde de
ruthénium RuO2 appliqué sur un substrat de titane.
5. En supposant la
liaison Ru-O parfaitement ionique, donner le nombre d'oxydation et la
configuration électronique de l'élément ruthénium Z = 44) dans le
composé RuO2.
n.o(Ru) + 2 x(-2) = 0 ; n.o(Ru) = +IV.
Configuration électronique de l'atome de ruthénium :
1s2 2s2 2p6 3s2 2p6 4s2 3d10 4p6 5s2 4d6.
Configuration électronique de l'élément ruthénium Z = 44) dans le composé RuO2.
1s2 2s2 2p6 3s2 2p6 4s2 3d10 4p6 5s0 4d4.
|
|
