Le
CO2 en solution aqueuse.
Concours agrégation interne 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
L'analyse de la concentration atmosphérique en CO2
montre une augmentation continue depuis plus de 150 ans. Cette
concentration atteint en 2019 la valeur record de 415 ppmv. Cette
augmentation s'est accélérée au cours de la dernière décennie pour
atteindre près de 2 ppmv par an. En fait, les estimations actuelles de
production de CO2 due à l'utilisation par l'homme des
énergies fossiles prévoient un accroissement de 3,5 ppmv par an.
l'accroissement net est donc limité grâce à l'absorption du CO2 par les océans et la biosphère. La compréhension des échanges de CO2 entre ces compartiments est donc un enjeu scientifique majeur.
1. Dissolution du CO2 dans l'eau - Aspects thermodynamiques.
24.
En considérant que le dioxyde de carbone se comporte comme un gaz
parfait, déterminer la pression partielle de ce gaz pour une fraction
volumique de 415 ppmv sous une pression atmosphérique de 1 bar.
415 parties par million de volume d'air : PCO2 = 415 10-6 bar = 4,15 10-4 bar.
25.
On considère que l'équilibre de dissolution d'un gaz obéit à la loi de
Henry. Donner une formulation de cette loi en précisant ses limitations.
A
température constante et à saturation, la pression partielle dans la
phase vapeur d'un soluté volatil est proportionnelle à la fraction
molaire de ce corps dans la solution liquide.
Elle s'applique aux faibles concentrations de soluté ( < 0,05 mol / L) et à des pressions inférieures à 10 bar.
26. Lorsqu'il est dissout dans l'eau pure, le dioxyde de carbone forme les espèces H2CO3; HCO3- et CO32-. Nommer ces espèces.
Respectivement acide carbonique, ion hydrogénocarbonate ( bicarbonate) et carbonate.
27. La constante de l'équilibre de dissolution dans l'eau du dioxyde de carbone gazeux pour former H2CO3 aq vaut Kdiss = 3,36 10-2 à 25°C. Ecrire l'équation de dissolution de CO2 (g) dans l'eau et calculer la concentration molaire en H2CO3 aq pour une fraction volumique atmosphérique en dioxyde de carbone de 415 ppmv.
CO2 (g) + H2O(l) = H2CO3 aq : Kdiss = [H2CO3 aq] / PCO2 ;
[H2CO3 aq] = Kdiss PCO2 =3,36 10-2 x 4,15 10-4 =1,39 10-5 mol / L.
28. Déterminer le pH de la solution aqueuse obtenue.
H2CO3 aq + H2O(l) = H3O+aq + HCO3-aq ; Ka = 2,5 10-6.
Ka =[H3O+aq] [HCO3-aq] / [H2CO3 aq]
[H3O+aq] = [HCO3-aq] = x ; [H2CO3 aq] = C - [HCO3-aq]=C-x = 1,39 10-5 -x.
2,5 10-6 ( 1,39 10-5 -x) =x2 ;
x2 +2,5 10-6x -3,47 10-11=0 ; discriminant D =(2,5 10-6)2 +4 *3,47 10-11 =1,45 10-10 =(1,2 10-5)2.
La solution positive est retenue : x = 7,25 10-6 mol / L. pH = - log(7,25 10-6) = 5,1.
29. Exprimer la solubilité totale du dioxyde de carbone dans l'eau en fonction de la pression partielle du CO2
(g) au dessus de la solution, du pH et des constantes thermodynamiques.
La calculer dans un eau à pH = 8,2. Expliquer pourquoi on dit que
l'océan agit comme un puits de carbone. Quelle influence aura à long
terme, cette dissolution du CO2 (g) sur le pH océanique ?
K°diss = [CO2aq] / PCO2 ;
Ka1 = [H3O+][HCO3-] / [CO2aq] ;
Ka2 = [H3O+][CO32-] /[HCO3-]. [CO2aq] =K°1 PCO2 C°/ P°.
s = [CO2aq] +[HCO3-] +[CO32-] =[CO2aq] (1+[HCO3-] / [CO2aq]+ [CO32-] / [CO2aq]).
s = [CO2aq] (1 +Ka1 / [H3O+] + Ka1 Ka2/ [H3O+]2 ).
s = K°dissC°/ P° PCO2 (1 +Ka1 / [H3O+] + Ka1 Ka2/ [H3O+]2 ).
A pH = 8,2 : s = 3,36 10-2 x 4,15 10-4 (1+10-6,4 / (10-8,2) +10-6,4 10-10,3 / (10-8,2)2)
s =1,39 10-5(1+63 +2)=9,2 10-4 mol / L.
L'océan agit comme un puits à carbone : le
dioxyde de carbone entre dans la chaîne alimentaire (algues type
diatomées) en suspension dans les eaux de surface. Ces algues
consomment le dioxyde de carbone dissous par photosynthèse ; d'autres
organismes marins fixent le carbone dans leurs coquilles calcaires.
Pour
mettre en évidence un dégagement de dioxyde de carbone, on utilise de
l'eau de chaux. On constate l'apparition d'un précipité de
carbonate de calcium. En présence d'un excès de CO2 ce précipité disparaît.
Certains organismes marins ont une coquille à base de carbonate de calcium. Conséquence d'une augmentation du dioxyde de carbone dissous pour ces organismes marins : les coquilles seront plus minces et plus fragiles.
30. Copie d'élève à annoter.


|
...
|
....
|
2. Aspects cinétiques de cette dissolution.
Le mécanisme de dissolution de CO2(g) dans l'eau met en jeu une première étape de solubilisation dannant CO2 aq suivie par une étape lente d'hydratation conduisant à la formation de H2CO3aq. Cette deuxième étaoe peut s'écrire :
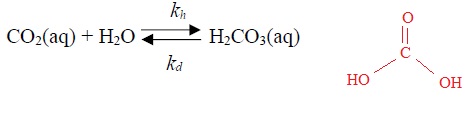
kh = 0,030 s-1 ; kd = 30 s-1 à 25°C.
31. Quelle est la géométrie de la molécule H2CO3. Proposer une explication pour la lenteur de la réaction d'hydratation de CO2.
CO2 est une molécule apolaire et H2O est un solvant polaire. Ces deux molécules ont des caractéristiques trop éloignées pour procéder à une union. De plus H2CO3 réagit avec l'eau pour former l'ion HCO3- et l'oion H3O+.
32. A pH neutre, la dissolution de CO2 (g) implique la déprotonation de H2CO3 aq et la formation de l'ion HCO3-. Sachant que la constante de vitesse de la réaction de l'ion HCO3- avec l'ion H3O+ est d'environ 1010 L mol-1 s-1, montrer que l'on peut utiliser l'approximation de l'état stationnaire pour H2CO3.
Soit un intermédiaire réactionnel B, formé lors d'une étape et rapidement consommé dans une seconde étape :
B ne peut pas s'accumuler dans le milieu réactionnel ; sa concentration reste faible et pratiquement constante.
En conséquence la vitesse de formation de B, d[B]/dt est proche de zéro.
33. En déduire l'expression de la vitesse de disparition de CO2 aq en fonction de kh, kd, ka1 constante d'acidité du couple H2CO3 / HCO3-, et des concentrations des différentes espèces.
d[CO2 aq] / dt =kd [H2CO3aq] - kh[CO2 aq] ;
Ka1 = [H3O+ aq] [HCO3- aq] / [H2CO3aq].
[HCO3- aq] = [H3O+ aq] [HCO3- aq] /
Ka1.
d[CO2 aq] / dt =kd /
Ka1 [H3O+ aq] [HCO3- aq] - kh[CO2 aq] ;
d[CO2 aq] / dt =30 / 10-6,4 [H3O+ aq] [HCO3- aq] - 0,030[CO2 aq] ;
A pH = 7 :
d[CO2 aq] / dt =7,5 [HCO3- aq] - 0,030[CO2 aq].
A pH > 8, un autre mécanisme entre en compétition pour la formation de l'ion HCO3-.
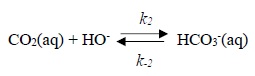
k2 =8500 Lmol-1 s-1 ; k-2 = 2 10-4 s-1 à 25°C.
34. Comparer qualitativement les vitesses d'addition de HO- et H2O sur CO2 et proposer une interprétation de leur différence.
d[CO2 aq] / dt =k-2 [HCO3- aq] - k2[CO2 aq][HO-aq] ;
d[CO2 aq] / dt =2 10-4 [HCO3- aq] - 8500 x10-6 [CO2 aq] ;
d[CO2 aq] / dt =2 10-4 [HCO3- aq] - 8,5 x10-3 [CO2 aq].
CO2 aq est un acide faible ; HO-aq est une base forte : l'addition de HO- sur CO2 est beaucoup plus rapide.
3. Dosage du CO2 dissous dans les analyses du secteur agroalimentaire.
35. La solubilisation du CO2(g) est-elle une réaction exo ou endothermique ? Justifier.
La solubilité du CO2(g) diminue quand la température augmente.
DrH° = DfH°(CO2aq) -DfH°(CO2 g) =-413,8 -(-393,5)= -20,3 kJ /mol.
DrH° < 0, réaction exothermique défavorisée dans le sens direct par une augmentation de température à pression constante.
Les résultats du titrage d'une solution décimolaire d'ions HCO3- et CO32- par un acide fort concentré permettant de négliger la variation de volume sont représentés de façon simplifiée.
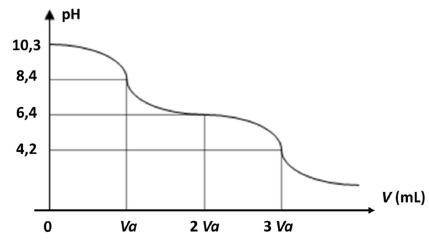
36. Justifier les valeurs du pH obtenu pour V = 0 et 2Va. Préciser pour chaque volume les espèces acido-basiques majoritaires.
V =0 : mélange équimolaire d'ions HCO3- et CO32- , pH = pKa du couple HCO3- / CO32- .
V = 2 Va : titrage HCO3- avec arrêt à la demi équivalence ; mélange équimolaire d'ions HCO3- et CO2 aq , pH = pKa du couple CO2 aq / HCO3- .
37. Quels indicateurs colorés utiliseriez-vous pour repérer les équivalences en V=Va et V = 3 Va ?
La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent.
V = Va : mauve de crésol [7,4 ; 9,0 ].
V = 3 Va : hélianthine [3,1 ; 4,4] .
Méthode de dosage titrimétrique du CO2 dissous dans une boisson gazeuse.
Le
volume de vin prélevé sur l'échantillon amené au voisinage de 0°C est
versé dans un excès sufisant de solution titrée d'hydroxyde de sodium
pour avoir un pH de 10-11. On titre avec une solution acide en présence
d'anhydrase carbonique. La teneur en dioxyde de carbone est déduite du
volume versé pour passer de pH = 8,4 à pH = 4,2.
a) Refroidir l'échantillon de vin aux environ de 0°C ainsi que la pipette servant à son prélèvement.
b) Prélever dans un becher de 100 mL, 25 mL de solution d'hydroxyde de sodium à 0,1 mol / L.
c) Y intoduire 10 mL de vin au moyen d'une pipette refroidie à 0°C.
d) Ajouter 2 gouttes de solution aqueuse d'anhydrase carbonique à 1 g / L.
e) Placer le becher sur l'agitateur magnétique, mettre en place
l'électrode et le barreau magnétique et procéder à une agitation
modérée.
f) Lorsque le liquide est revenu à température ambiante, ajouter
progressivement une solution à 0,05 mol / L d'acide sulfurique jusqu'à
pH = 8,4.
g) Continuer les ajouts d'acide sulfurique 0,05 mol / L jusqu'à pH = 4,2.
Soit V le volume d'acide sulfurique utilisé entre pH = 8,4 et pH = 4,2.
h) Procéder par ailleurs à l'élimination du CO2 sur 50 mL de
l'échantillon de vin initial par agitation sous vide pendant 3 minutes,
en réchauffant la fiole dans un bain d'eau à 35°C environ.
i) Appliquer sur 10 mL de vin décarboniqué le même mode opératoire que ci-dessus. Soit V' le volume d'acide sulfurique utilisé.
38. Pourquoi refroidit-on l'échantillon de vin mousseux à 0°C dans l'étape a ?
A 0°C la solubilité du dioxyde de carbone est maximale, 3,346 g / L
sous P = 1 bar. Cette solubilité diminue(1,26 g / L à 30°C ) quand la
température augmente.
39. Quel est le rôle de l'hydroxyde de sodium dans le étapes d et e ? Le volume ajouté doit-il être connu avec précision ?
L'anhydrase carbonique transforme CO2 aq en H2CO3 aq.
L'hydroxyde de sodium transforme H2CO3 aq en ion hydrogénocarbonate et carbonate.
Le
volume dh'ydroxyde de sodium versé n'est pas connu avec précision, car
seul le volume V d'acide sulfurique titrant l'ion
hydrogénocarbonate entre pH =8,4 et pH = 4,2 est utile.
39. Expliquer pourquoi on mesure le volume V (mL) d'acide sulfurique
0,05 mol / L versé entre pH =8,4 et pH = 4,2 ? Quelle est
l'espèce titrée dans cette gamme de pH ? Etablir la relation entre le
volume V et la concentration en CO2 dissous.
L'ion hydrogénocarbonate est très majoritaire entre pH = 8,4 et pH = 4,2.
L'acide sulfurique est un diacide fort.
[CO2 aq]x Vvin =V x 2 x[ acide sulfurique] ; [CO2 aq]=0,05 x 2 V / 10 = 0,01 V avec V en mL.
40. Quel est l'intérêt du titrage témoin réalisé dans les mêmes conditions sur un vin décarbonaté ?
Dans le vin, le dioxyde de carbone dissout se trouve sous forme CO2aq, HCO3-aq et CO32-aq.
41. Montrer que l'expression de la quantité de CO2 en g / L de vin est Q = 0,44 (V-V').
[CO2 aq] = 0,01 (V-V') mol / L.
ou M(CO2)[CO2 aq]= 44 [CO2 aq] g / L.
44 *0,01(V-V') =0,44 (V-V').
|
|