Analyse
d'un piment à base d'oxyde de fer. Bac Amérique du
Nord 2021.
absorbance, loi de Beer-Lambert.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
La teneur en oxyde de fer( Fe2O3) d'une poudre est de 5% selon le fabricant.
L'analyse de ce produit s'effectue selon un dosage par étalonnage qui se déroule en trois étapes.
Préparation d'une gamme étalon.
Réalisation d'une courbe d'étalonnage à l'aide de mesures spectrophotométriques.
préparation et analyse de l'échantillon.
A. Réalisation d'une gamme étalon de solutions d'ion fer III.
On ajoute des ions thiocyanate aux ions fer III. On réalise la gamme étalon à partir d'une solution mère S0 contenant des ions fer III en milieu acide à la concentration en masse en ion fer III : C=25,0 mg / L.
On prépare 250,00 mL de solution mère par dissolution de chlorure de fer III hexahydraté FeCl3, 6 H2O.
A.1.
Ecrire l'équation de dissolution du chlorure de fer III solide et
déterminer la masse de soluté nécessaire à l'obtention de S0.
FeCl3 s --> Fe3+aq + 3Cl-aq.
25,0 x0,25 = 6,25 mg d'ion fer III dans S0.
Quantité de matière correspondante : 6,25 10-3 / M(Fe) = 6,25 10-3 / 55,9 =1,118 10-4 mol.
M(FeCl3, 6 H2O) = 55,9 +3 x35,5 +6 x18 =270,4 g / mol.
Masse de soluté : 1,118 10-4 x 270,4 =0,030 g.
Pour préparer 50,00 mL de chaque solution Si de la gamme, on prélève un volume Vi
de solution mère auquel on ajoute 1,00 mL de solution de thiocyanate de
potassium et on compète jusqu'au trait de jauge avec de l'eau distilée.
Solution
|
S1
|
S2
|
S3
|
S4
|
S5
|
Concentration masique en ion fer III ( mg / L)
|
1,00
|
2,00
|
3,00
|
4,00
|
5,00
|
A.2. Nommer la verrerie nécessaire à la réalisation de S5.
Fiole jaugée de 50,0 mL.
Facteur de dilution F = C / C(S5) =25,0 /5 = 5.
Volume de solution S0 à prélever : 50 / 5 = 10,0 mL ( pipette jaugée de 10,0 mL).
On
réalise le spectre d'absorption d'une solution d'ion fer III en
présence d'ion thiocyanate dans les mêmes conditions que celles
appliquées aux solution de la gamme étalon.
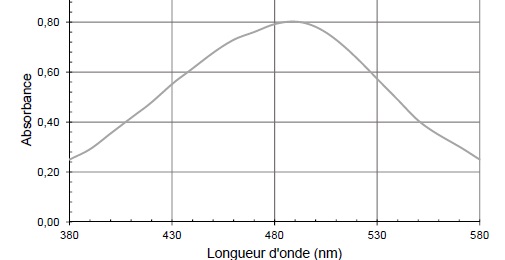
A.3. Quelle est la couleur de la solution ?
Le maximum d'absorption se situe vers 490 nm (cyan). La couleur de la
solution est la teinte complémentaire du cyan, soit le rouge.
A.4. Indiquer la longueur d'onde la plus adaptée pour effectuer les mesures d'absorbance.
Pour un maximum de précision, on se place au maximum d'absorption, 490 nm.
|
....
|
Réalisation de la courbe d'étalonnage.
On mesure l'absorbance des solutions S1 à S5 et on trace la courbe d'étalonnage suivante.
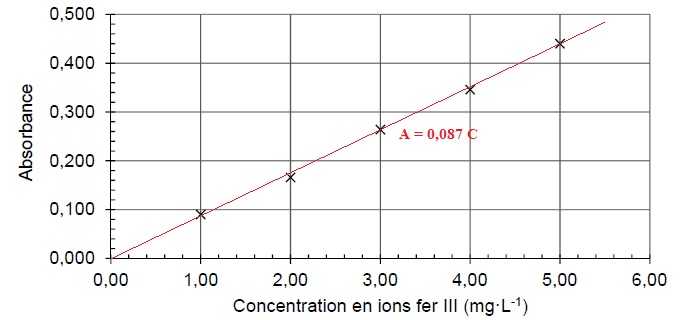
1. Expliquer pourquoi le graphe est compatible avec la loi de Beer-Lambert.
Les points sont alignés : absorbance et concentration sont proportionnelles.
2. Etablir la relation liant absorbance et concentration.
Concentration C ( mg/ L)
|
1
|
2
|
3
|
4
|
5
|
Absorbance A
|
0,09
|
0,166
|
0,264
|
0,346
|
0,440
|
A / C
|
0,09
|
0,084
|
0,088
|
0,0865
|
0,088
|
Valeur moyenne : 0,087.
C. Préparation de l'échantillon.
La solubilité du piment augmente avec le caractère acide du milieu. On
dissout à froid 100,0 mg de produit commercial dans 20,0 mL d'acide
chlorhydrique concentré. Une mole d'oxyde de fer Fe2O3 libère deux moles d'ions fer III.
Après dissolution, on introduit le mélange dans une fiole jaugée de
100,0 mL et on complète jusqu'au trait de jauge avec de l'eau
distillée. On nomme S la solution obtenue.
Après dilution au dixième de la solution S, l'achantillon est préparé
comme la gamme précédente. On mesure l'absorbance de cet échantillon et
on obtient la valeur A = 0,313.
1. Pouquoi est-il nécessaire de diluer la solution S ?
Concentration et absorbance sont proportionnelles uniquement aux faibles concentrations.
2. Déterminer la teneur de la poudre en oxyde de fer.
C = A / 0,087 = 0,313 / 0,087 ~ 3,6 mg / L d'ion fer III.
Soit 0,36 mg d'ion fer III dans 100 mL.
Soit 3,6 10-4 / M(Fe) = 3,6 10-4 / 55,9 =6,44 10-6 mol d'ion fer III.
Une mole d'oxyde de fer Fe2O3 libère deux moles d'ions fer III.
6,44 10-6 / 2 = 3,22 10-6 mol de Fe2O3.
M(Fe2O3) = 2 x55,9 +3 x16 =159,8 g / mol.
Masse d'oxyde de fer III : 3,22 10-6 x159,8 =5,14 10-4 g =0,514 mg.
0,514 mg d'oxyde de fer III dans 100 mg de poudre correspond à 0,5 %.
L'indication n'est pa correcte.
|
|

