Protection
des fondations en acier des éoliennes en mer. Bac Amérique du
Nord 2021.
Oxydoréduction, fonctionnement d'une pile.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Le système de protection dit" par courant imposé" évite le rejet de métaux dans l'environnement.
On s'interesse au processus de protection cathodique.
A. Protection du fer par l'aluminium.
On met en contact électrique du fer et de l'aluminium qui joue le rôle d'anode sacrificielle.
Par oxydation, le fer donne des ions Fe2+ et l'aluminium donne des ions Al3+.
On réalise la pile suivante :
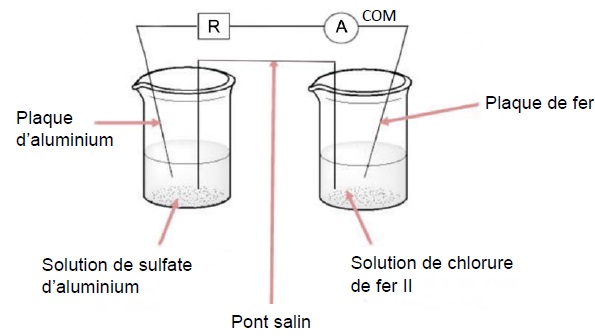
V1 = 50,0 mL de chlorure de fer (II) de concentration C1 = 0,10 mol / L.
V2 = 50,0 mL de sulfate d'aluminium de concentration C2 = 0,050 mol / L.
Equation de la réaction qui modélise la transfoormation susceptible de se produire :
2Al(s) + 3Fe2+aq = 2Al3+aq + 3Fe(s). Constante d'équilibre K = 10166.
A.1. Exprimer le quotient initial Qr, i.
Qr, i = [Al3+aq] 2 / [Fe2+aq]3.
A.2. Calculer à l'état initial [Al3+aq] et [Fe2+aq].
[Fe2+aq] =C1 = 0,10 mol / L.
[Al3+aq]=2C2 = 0,10 mol / L.
A.3. Calculer Qr, i et en déduire le sens dl'évolution spontanée de la transformation.
Qr, i = [0,10] 2 / [0,10]3 = 10.
Qr, i < K, évolution spontanée dans le sens direct.
A.4. En déduire la réaction se produisant à l'électrode d'aluminium.
L'aluminium s'oxyde selon :
Al(s) ---> Al3+aq + 3e-.
L'ampèremètre figurant sur le schéma indique une valeur négative.
A.5. Montrer que cette valeur est cohérente avec la réponse précédente.
L'aluminium constitue la borne négative de la pile.
La borne COM de l'ampèremetre est reliée au fer, borne positive de la pile.
L'anode est l'électrode siège d'une oxydation. La cathode est le siège d'une réduction.
A.6. Identifier l'électrode qui joue le rôle d'anode.
L'aluminium s'oxyde et joue le rôle d'anode.
|
....
|
Masse d'aluminium nécessaire à la protection de la structure métallique d'une éolienne.
Le
dioxygène dissout dans l'eau réagit préférentiellement avec
l'aluminium de l'anode sacrificielle plutôt qu'avec le fer de la
structure.
1. Ecrire l'équation de la réaction modélisant la transformation chimique de corrosion de l'aluminium par le dioxygène dissous.
4 fois { Al(s) ---> Al3+aq + 3e- }
3 fois { O2 aq +2H2O(l) +4e- --> 4HO-aq }.
4 Al(s) +3O2 aq +6H2O(l)---> 4 Al3+aq +12HO-aq.
Une protection efficace correspond à un courant électrique de l'ordre de 400 A.
2. Calculer la masse d'aluminium nécessaire à la protection cathodique pendant une durée de 25 ans.
Durée t = 25 x365 x24 x3600 =7,88 108 s.
Quantité d'électriicité Q = I t = 400 x7,88 108 =3,15 1011 C.
Quantité de matière d'électrons : n =3,15 1011 / 96500 =3,27 106 mol.
Quantité de matière d'aluminium : n / 3 = 3,27 106 /3 =1,09 106 mol.
Masse d'aluminium m = n(Al) M(Al) = 1,09 106 x27 =2,9 107 g = 27 tonnes.
3. Citer au moins un argument expliquant que le constructeur ait renoncé à cette protection par anode sacrificielle.
Rejet de métaux dans l'environnement.
Coût important de l'aluminium.
|
|
