Etude
d'un lait,
Bac Stl 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Etude
de l'acide lactique. ( d'après bac S Liban 2013).
1. Représenter la molécule d'acide lactique en forme topologique.
2. Entourer les groupes caractéristiques présents et nommer les fonctions correspondantes.
3. Repérer par un astérisque l'atome de carbone asymétrique et donner la représentation de Cram d'un des stéréoisomères.
Définir couples d'énantiomères.
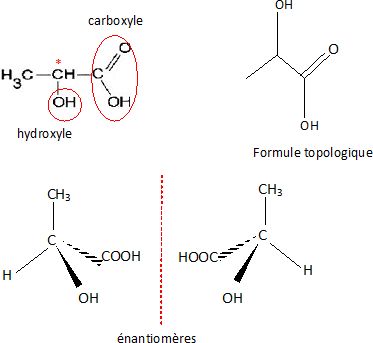
Fonction alcool secondaire et fonction acide carboxylique.
Deux énantiomères sont images l'un de l'autre dans un miroir plan.
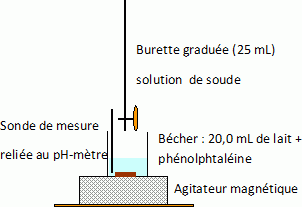
Dosage de l'acidité d'un lait. d'après bac St2S 09/2012.
La teneur en acide lactique d'un lait est un indicateur de sa
fraîcheur. Le degré de fraîcheur d'un lait peut se vérifier en
déterminant la concentration molaire Ca de
l'acide lactique dans ce lait. Pour cela, on effectue un dosage
pH-métrique d'un volume V = 10,00 mL du lait,
par une solution aqueuse d'hydroxyde de sodium ( Na+aq
+ HO-aq ) de concentration C1 =
0,111 mol/L.
1. Faire
le schéma annoté du dispositif utilisé pour ce dosage pH-métrique.
2. Ecrire l'équation de la réaction support du titrage.
L’équation
de la réaction de dosage s’écrit :
CH3-CHOH-COOH
+ HO- -->
CH3-CHOH-COO-
+H2O. (1)
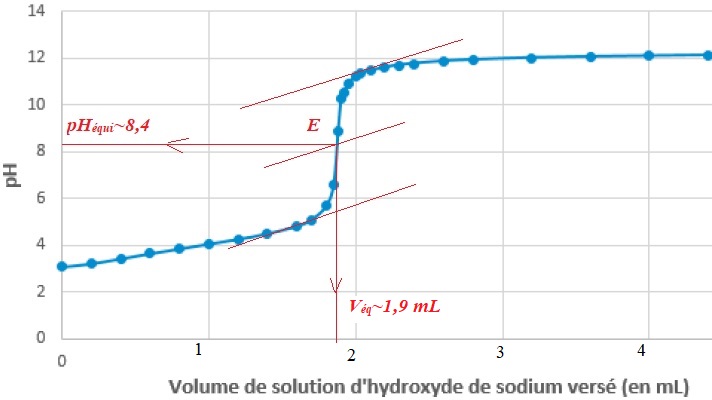
3. Indiquer l'indicateur coloré à choisir en justifiant.
Le pH du point équivalent étant voisin de 8,4, on choisit la
phénolphtaleine, dont la zone de virage contient le pH du point
équivalent.
L'incertitude u(V) sur le
volume de la prise d'essai est de 0,02 mL, l'incertitude relative u(c1)
/ c1 de la solution titrante est 0,5 % et on estime u(VE) =0,05 mL ; u(cm)= 0,05 g /L.
V = 10,00 ±0,02 mL ; c1 = (0,111 ±0,001 mol /L ; Veq = (1,9 ±0,05) mL
M(acide lactique) = M = 90 g/mol.
4. Indiquer si le lait est frais en justifiant.
A l'équivalence : CV = C1 Véq ; C = C1 Véq / Va ;.
Titre massique en acide lactique : cm=C M = C1 Véq M / V =0,111 x1,9 x90 /10~(1,9 ±0,05) g / L.
Un degré Dornic correspond à 0,1 g /L d'acide lactique.
Acidité de ce lait : 19°D valeur supérieure à 18°D : ce lait n'est pas frais.
4. En utilisant la
soude Dornic pour doser un lait à 18°D, le volume équivalent est de
1,80 mL. En déduire l'intérêt pratique à choisir cette soude Dornic
pour mesurer l'acidité d'un lait.
Degré Dornic du lait =10 x Volume équivalent.
En multipliant par 10 le volume équivalent exprimé en mL, on obtient directement le degré Dornic du lait.
|
| .
. |
....
|
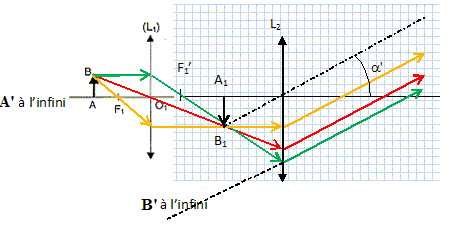
Observation au microscope optique des bactéries présentes dans le lait. D'après Bts bioanalyse 2013.
Le microscope est réglé pour donner une image A'B' à l'infini d'un objet réel perpendiculaire à l'axe optique.
Intervalle optique D = 160,0 mm ; grandissement de l'objectif |g |=40 ; grossissement de l'oculaire Goculaire = 10.
1. Quel est l'intérêt de former une image à l'infini ?
L'oeil n'accommode pas et observe sans fatigue.
2. Donner la position de l'image intermédiaire.
L'image définitive étant à l'infini, l'image intermédiaire se trouve au foyer objet de l'oculaire.
3. Compléter le schéma de principe du microscope.
4. Définir le grandissement de l'objectif.
|g| = O1A1 / |O1A| = D / f '1.
5. Montrer que la valeur de la distance focale de l'objectif est f '1 = 4,00 mm.
f '1 = D / |g| =160,0 / 40 =4,00 mm.
6. Déterminer la distance objet - objectif.
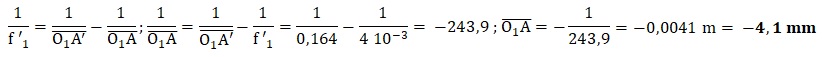
7. Calculer le grossisement commercial Gc = |g| Goculaire =40 x 10 = 400.
8. Le pouvoir de résolution est limité par la diffraction. La dimension ABmini du plus petit objet observable est donnée par : ABmini = 0,6 l / O.N ; O.N ouverture numérique; l : longueur d'onde de la lumière utilisée.
Déterminer ABmini si O.N =0,65 et l = 500 nm.
ABmini =0,6 x 500 10-9 / 0,65 =4,6 10-7 m ou 0,67 µm.
Les lactobacilles de taille moyenne 3 µm sont donc observables. Les
virus de taille moyenne bien inférieure à 0,67 µm ne sont pas
observables.
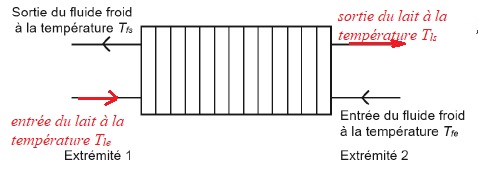
Stockage du lait dans les "tanks" à lait.
Le
lait issu de la traite est préalablement refroidi par l'intermédiaire
d'un échangeur à plaques fonctionnnant à contre-courant.
1. Identifier le fluide chaud et le fluide froid dans cet échangeur.
Le fluide chaud est la lait qui sort de la traite et le fluide froid est l'eau.
2. Compléter le schéma suivant :
3. Citer les modes de transferts thermiques mis en jeu dans cet échangeur.
Conduction et convection.
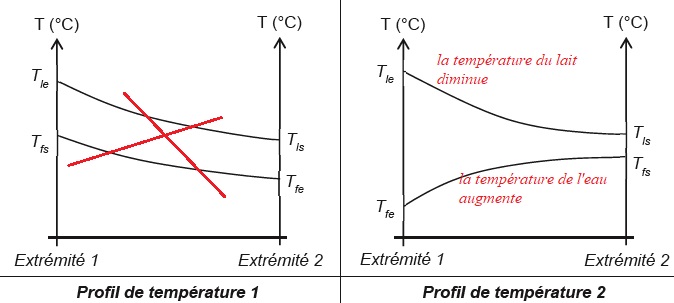
4. Parmi les profils de température ci-après, indiquer celui qui correspond au fonctionnement de l'échangeur. Justifier.
On cherche à déterminer si les parois de la cuve du tank sont
suffisamment isolées en cas de coupure d'électricité. La cuve contient
450 L de lait.
5. Montrer que l'aire de la surface totalele de la cuve cylindrique est d'environ 5,3 m2.
Diamètre de la cuve d = 2 R = 80 cm ; longueur de la cuve L = 170 cm.
Surface latérale = p d L = 3,14 x 0,8 x1,70 ~4,27 m2.
Surface des deux extrémités : 2 p d2 / 4= 6,28 x0,82 /4~1,00 m2.
Stot = 4,27 +1 ~5,3 m2.
6. Montrer que la valeur de la résistance thermique globale de la paroi est Rth = 0,62 K W-1.
Rth =( eacier / lacier +emousse / lmousse ) / Stot =( 3 10-3 /16,3 +76 10-3 / 0,023) / 5,3 ~0,62 K W-1.
7.
Déterminer la valeur de la puissance thermique échangée à travers la
paroi de la cuve lorsque la température extérieure est de 32°C et que
le lait est à 4,0 °C à l'intérieur.
Pth =|Dq| / Rth =(32-4) / 0,62 = 45,16 ~45 W.
8. Déterminer la valeur de l'énergie thermique reçue par le lait en 24 heures.
Q = Pth x durée = 45 x24 x3600 ~3,9 106 J.
9. Quelle alors l'augmentation de la température du lait ? Conclure.
Masse volumique du lait : rlait = 1,03 103 kg m-3 ; capacité thermique massique du lait : clait =3,8 103 J kg-1 K-1. V = 0,45 m3.
Augmentation de la température du lait : Q / (V rlaitclait ) =3,9 106 /(0,45 x1,03 103 x3,8 103)=2,2 °C.
Cette valeur étant supérieure à 1°C, l'isolation est insuffisante.
Etude d'un lait aromatisé à l'ananas. D'après bac Amérique du Sud 2017.
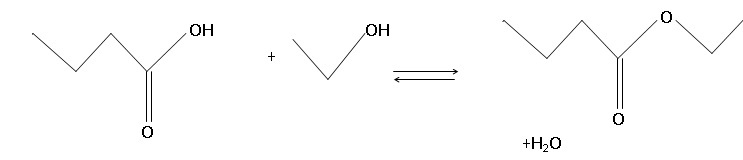
1. Nommer la réaction chimique permattant de synthétiser le butanoate d'éthyle.
Estérification.
2. Écrire
l’équation de la réaction de cette synthèse en utilisant les formules
topologiques des espèces mises en jeu.
3. Compléter à l'aide de flèches courbes.
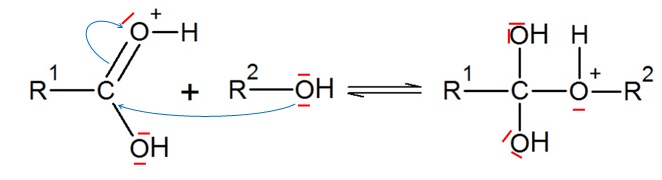
4. Parmi les termes suivants choisir le terme correspondant à l'étape 4.
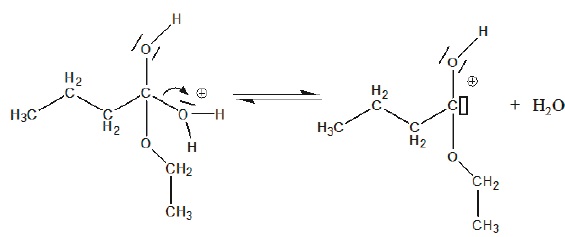
Elimination d'une molécule d'eau.
5. Préciser le rôle du catalyseur.
Il accélère la réaction ; l'équilibre est plus rapidement atteint, sa composition reste inchangée.
6. Identifier la catalyseur.
Le catalyseur H+ intervient à l'étape 1 et se trouve régénéré à la dernière étape.
7. Indiquer une méthode de purification possible du butanoate d'éthyle.
L'éthanol est en excès, l'acide butanoïque en défaut.
Température d'ébullition de l'éthanol : 79°C ; température ébullition ester : 121 °C.
Purification par distillation.
8. A partir du spectre IR du produit purifié, indiquer si le butanoate d'éthyle est pur. Justifier.
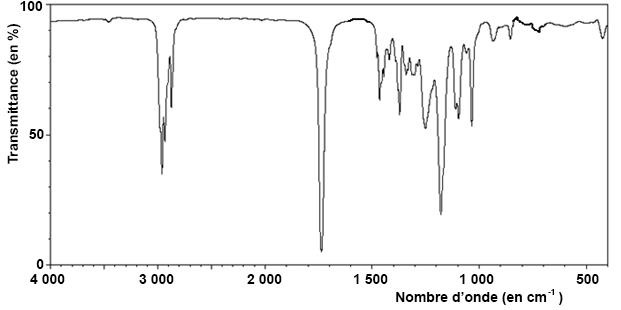
Disparition de la large bande vers 3200 cm-1 due à la
présence de OH lié par liaison hydrogène. L'ester est pur.
9. Montrer que le rendement est d'environ 55 %.
A partir de 0,50 mol d'acide butanoïque ( réactif en défaut), on peut obtenir au mieux 0,50 mol d'ester.
M(ester) = 116 g / mol ; masse théorique d'ester : 116 x0,5 = 58 g.
Masse réelle d'ester : 31,9 g. Rendement = 31,9 /58 ~0,55 ( 55 %).
10. Comment augmenter le rendement ?
Eliminer le produit le plus volatil ( l'eau) au fur et à mesure qu'il se forme.
Mettre le réactif le moins coûteux en large excès.
|
|