Le
bicarbonate de sodium, bac S Nlle Calédonie 12 / 2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
Le but de cet exercice est de comprendre le rôle des ions bicarbonate dans quelques utilisations de la vie courante.
1. Dosage du bicarbonate de sodium alimentaire.
Après dissolution de la poudre alimentaire dans l'eau, on effectue un
titrage de cette solution par de l'acide chlorhydrique.
Le protocole est le suivant :
- dissoude 10,0 g de poudre dans de l'eau pour obtenir 1,00 L de solution notée S0.
- prélever 20,0 mL de cette solution et l'introduire dans un becher.
- placer une sonde pH-métrique préalablement étalonnée dans le becher.
- ajouter un peu d'eau pour que la sonde soit correctement immergée.
- placer le becher sur agitateur magnétique et sous la burette remplie d'acide chlorhydrique de concentration c = 0,200 mol/L.
- mesurer le pH de la solution du becher après chaque ajout d'acide.
1.1. Décrire précisément le protocole permettant d'obtenir la solution S0.
Peser à l'aide d'une balance de précision 10,0 g de poudre.
La verser dans une fiole jaugée de 1,00 L contenant 2/3 d'eau distillée.
Rincer la coupelle à l'eau distillée.
Agiter jusqu'à dissolution complète.
Compléter la fiole jusqu'au trait de jauge à l'aide d'eau distillée. Agiter pour rendre homogène.
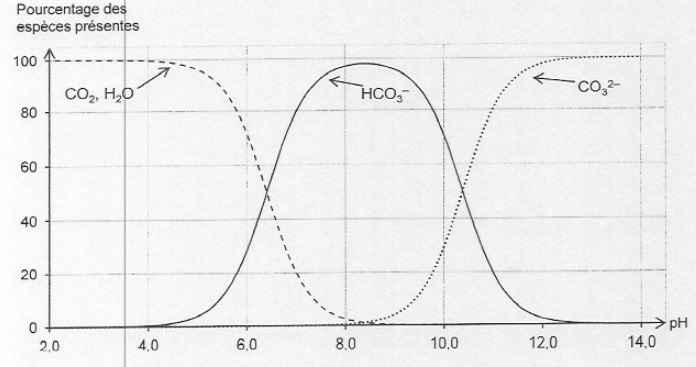
1.2. Justifier que l'ion bicarbonate HCO3-aq est majoritaire au début du titrage. Préciser l'espèce prédominante en fin de titrage.
Au début du titrage, le pH est voisin de 8. A ce pH, l'ion bicarbonate HCO3-aq est majoritaire.
En fin de titrage, le pH est voisin de 2 ; à ce pH, CO2, H2O est majoritaire.
1.3. En déduire l'équation de la réaction support du titrage.
HCO3-aq +H3O+aq --> CO2, H2O +H2O.
1.4.
Définir l'équivalence et expliquer pourquoi le fait de rajouter
de l'eau ne change pas la valeur du volume versé à l'équivalence.
A l'équivalence, les réactifs sont en proportions stoechiométriques. Avaant l'équivalence, HCO3-aq est en excès ; après l'équivalence, H3O+aq est en excès.
L'eau distillée ajoutée ne contient pas d'ion HCO3-aq et très peu d'ion H3O+aq. La valeur du volume versé à l'équivalence est inchangé.
1.5 Quel est le degré de pureté du bicarbonate alimentaire ?
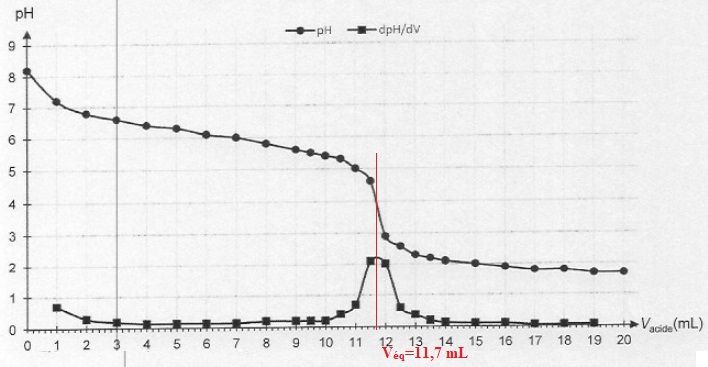
A l'équivalence, quantité de matière d'acide versé = quantité de matière d'ion HCO3-aq :
n = c Véq =0,200 x 11,7 =2,34 mmol dans 20,0 mL de solution soit 2,34 x 1000 / 20 =117 mmol = 0,117 mol.
M(bicarbonate de sodium) = 84,0 g / mol.
masse de bicarbonate de sodium : 0,117 x 84,0 =9,83 g dans 10 g de poudre.
Degré de pureté : 9,83 / 10,0 = 0,983 ( 98,3 %).
2. Décomposition thermique du bicarbonate de sodium.
A partir de 50 °C le bicarbonate de sodium se décompose pour former du dioxyde de carbone gazeux.
On chauffe une masse m = 2,0 g de bicarbonate de sodium. On récupère V = 286 mL de CO2 mesuré à 20°C sous pression atmosphérique.
2.1. Montrer que la quantité de dioxyde de carbone est n = 1,19 10-2 mol.
Volume molaire des gaz dans ces conditions : 24 L / mol.
n = 0,286 / 24 =1,19 10-2 mol .
2.2. Identifier la réaction qui modélise cette décomposition thermique parmi les deux proposées ci-dessous.
2 NaHCO3(s) --> Na2O(s) +2CO2(g) +H2O(g). (1)
2 NaHCO3(s) --> Na2CO3(s) +CO2(g) +H2O(g). (2).
n(bicarbonate) = 2,0 / 84 =0,024 mol.
(1) conduit à 0,024 mol de dioxyde de carbone, différent de 1,19 10-2 mol.
(2) conduit à 0,012 mol de dioxyde de carbone,voisin de 1,19 10-2 mol.
La réaction (2) est retenue.
2.3 Cette décomposition thermique est utilisée en cuisine et en sécurité incendie.
2.3.1
Lors de la préparation d'un gâteau, le bicarbonate de sodium est
incorporé en petite quantité avant la cuisson dans la pâte. Indiquer la
conséquence de cet ajout lors de la cuisson.
Lors de la cuisson le dégagement de dioxyde de carbone fait gonfler la pâte.
2.3.2. Pour lutter
contre les incendies, on cherche à arrêter la réaction de combustion
entre le dioxygène de l'air et le combustible. L'utilisation de
bicarbonate de sodium éjecté par certains extincteurs permet d'éteindre
des incendies sur lesquels on ne peut pas projeter d'eau. Expliquer
comment le bicarbonate ejecté permet d'éteindre un feu au sol.
La réaction chimique du bicarbonate de sodium sur le feu produit du dioxyde de carbone qui étouffera le feu.
|