Structure
et synthèse d'espèces odorantes, bac S Nlle Calédonie 12 / 2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
.
.
|
..
..
......
...
|
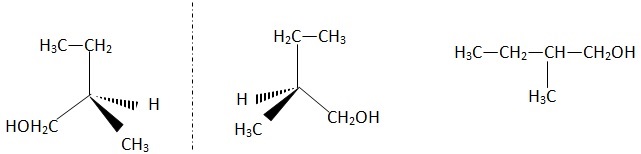
1. Odeurs et stéréochimie.
Les deux énantiomères du 2-méthylbutan-1-ol présentent des odeurs très
différentes ; l'un a une odeur fraîche et légère, l'autre a une odeur
de produit fermenté et gras. Ces deux molécules ont les mêmes
propriétés physico-chimiques.
Formule C5H12O, M=88,15 g / mol ; liquide incolore ; Tfusion = -117,2°C ; Tébullition = 128,7 °C ; solubilité dans l'eau : 31 g / L ; soluble dans l'éthanol, l'éther diéthylique, très soluble dans l'acétone.
1.1 et 1.2 Représenter la formule semi-développée du 2-méthylbutan-1-ol et les deux énantiomères.
1.3.
Lors d'une synthèse, on obtient les deux énantiomères en quantité
égale. Comment s'appelle un tel mélange ? Peut-on séparer les
énantiomères par distillation ? Justifier.
Mélange récémique.
Le énantioméres ayant la même température d'ébullition, on ne peut pas les séparer par distillation.
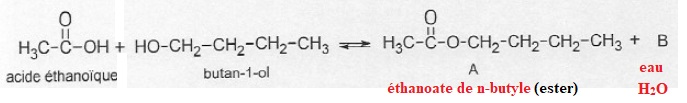
2. Synthèse d'une espèce odorante.
La réaction modélisant la synthèse de l'espèce odorante, nommée A est représentée ci-dessous.
2.1. Nommer A, préciser sa famille ; donner la formule brute de B.
2.2. Protocole de la synthèse.
1. Dans un ballon de 500 mL, placer 60 g d'acide éthanoïque pur et 37 g de butan-1-ol sous la hotte.
2. Ajouter prudemment 1 mL d'acide sulfurique concentré.
3. Placer un réfrigérant et chauffer à reflux pendant 6 heures.
4. Transvaser le mélange réactionnel refroidi dans une ampoule à décanter et ajouter 250 mL d'eau.
5. Séparer la phase organique et la laver à nouveau avec 100 mL d'eau,
puis avec 75 mL de solution aqueuse d'hydrogénocarbonate de sodium.
6. Sécher la phase organique avec 5 à 6 g de sulfate de sodium anhydre. Filtrer.
7. Procéder à la distillation du filtrat, collecter la fraction qui passe entre 124 et 126 °C.
On obtient 40 g de produit de synthèse.
2.2.1. Identifier le réactif en excès.
Acide éthanoïque : M =60 g/mol ; n = 60 / 60 = 1,0 mol.
Alcool : m = 74 g / mol ; n = 37 / 74 = 0,5 mol.
L'acide et l'alcool réagissent mole à mole.
L'acide éthanoîque est en excès.
2.2.2. Identifier les deux étapes du prorocole dont l'objectif est d'accélérer la réaction. Justifier.
Etape 2 : l'acide sulfurique est un catalyseur.
Etape 3 : la température est un facteur cinétique. Le chauffage à
reflux permet d'accélérer la réaction en évitant les pertes de matière
; les vapeurs se condensent dans le réfrigérant et retombent dans le
mélange réactionnel.
2.2.3 Expliquer l'intérêt de l'ajout des ions hydrogénocarbonate lors de l'étape 5.
L'ion hydrogénocarbonate est une base ; il neutralise l'acide sulfurique.
2.2.4 Une analyse
par spectroscopie IR du produit de synthèse permettrait-elle de
vérifier que les réactifs sont éliminés ? Justifier.
La présence de l'alcool donnerait une large bande vers 3200- 3700 cm-1. L'absence de cette bande signifie que l'alcool a été éliminé.
La présence de l'acide éthanoïque donnerait une bande large moyenne vers 2500- 3200 cm-1 ( O-H) ; il en est de même des liaisons C-H.
La présence de l'acide éthanoïque donnerait une bande forte vers 1680 - 1710 cm-1 (C=O) ; il en est de même de l'ester.
Une analyse par spectroscopie IR du produit de synthèse ne permet pas de vérifier que les réactifs sont éliminés.
2.2.5 Calculer le rendement de la synthèse et commenter.
On peut obtenir au mieux 0,5 mol d'ester ( M = 116 g / mol) soit 0,5 x 116 =58 g.
Rendement : masse réele / masse théorique =40 / 58 = 0,69 ( 69 %).
Ce rendement est assez faible, en tenant compte que l'acide éthanoïque a été introduit en excès..
|