Dosage
de l'ammoniac dans un produit ménager, bac S Métropole 2020.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Un liquide d'entretien de canalisation est constitué d'une solution aqueuse d'hydroxyde de sodium Na+aq + HO-aq, dans laquelle on dissout un colorant et un gaz. Ce gaz est de l'ammoniac NH3 dont le pourcentage massique dans la solution est compris entre 0,1 % et 0,5 % pour une bouteille neuve de ce produit.
L'ammoniac est assez volatil et s'échappe, sous forme de gaz, de la
solution dès que la bouteille est ouverte ; l'odeur désagréable qui en
résulte permet d'alerter les usagers lors de l'utilisation de ce
produit. La concentration en ammoniac de la solution diminue quand la
bouteille est ouverte.
1. Extraction de l'ammoniac du liquide d'entretien de canalisation.
Prélever 10 mL du liquide d'entretien.
Introduire ce volume dans un ballon.
Réaliser sous hotte le montage ci-après.
Recueillir le gaz extrait qui contient l'ammoniac, dans un erlenmeyer contenant 100 mL d'eau distilée. ( solution S).
Au bout d'une heure, remplacer l'erlenmeyer par un tube à essais rempli
d'eau distillée contenant du bleu de thymol et s'assurer que cette
solution reste jaune.
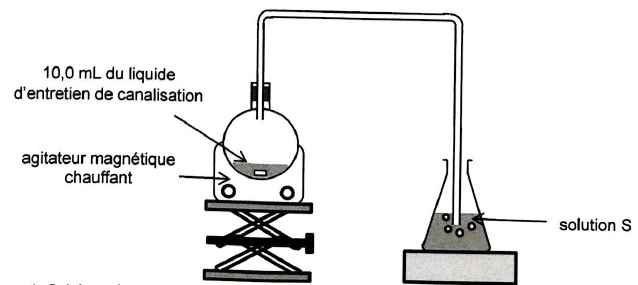
1.1. Indiquer le rôle du chauffage dans ce protocole.
La solubilité de l'ammoniac dans l'eau diminue lorsque la température augmente. Par chauffage, l'ammoniac s'évapore.
1.2. Expliquer pourquoi le test au bleu de thymol permet de faire
l'hypothèse que tout l'ammoniac contenu dans les 10,0 mL de ce liquide
d'entretien a bien été recueilli dans l'erlenmeyer.
L'ammoniac en solution dans l'eau est une base. Tant qu'il reste de
l'ammoniac en solution, le bleu de thymol est de couleur bleue. En
l'absence d'ammoniac en solution, ( solution neutre ou acide), le bleu
de thymol est de couleur jaune.
2. Détermination de la masse volumique du liquide d'entretien.
Placer une fiole jaugée de volume 200,0 mL sur une balance et réaliser la tare.
Remplir cette fiole de liquide d'entretien jusqu'au trait de jauge.
Peser la fiole remplie. On relève une masse m =220,4 g.
En déduire la masse volumique de ce liquide d'entretien.
220,4 / 200,0 =1,102 g cm-3.
|
...
|
....
|
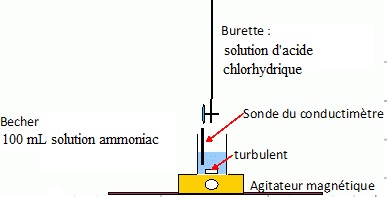
3. Titrage de l'ammoniac.
On réalise le titrage par conductimétrie de la totalité de la solution
S ( 100 mL) recueillie dans l'erlenmeyer par une solution aqueuse
d'acide chlorhydrique de concentration 1,0 10-1 mol / L.
L'équation support du titrage est : NH3 aq +H3O+aq ---> NH4+aq + H2O(l).
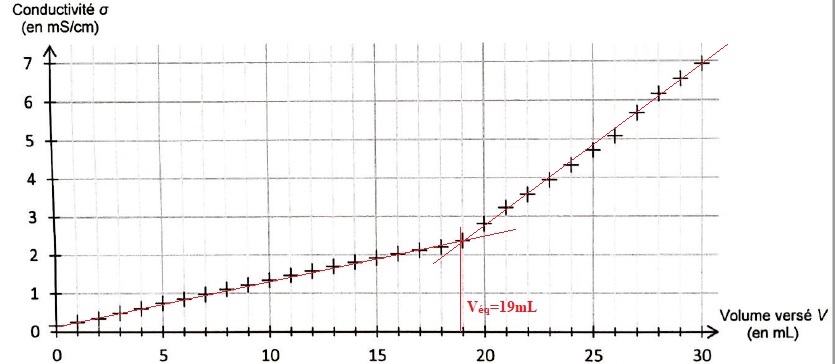
On donne l'évolution de la conductivité de la solution contenue dans le becher en fonction du volume de solution titrante versée
3.1. Réaliser un schéma légendé du dispositif de titrage.
3.2 Justifier que la réaction support du titrage est une réaction acido-basique.
Couples acide base mise en jeu : NH4+aq / NH3 aq et H3O+aq / H2O(l).
Il y a échange de protons entre la base NH3 aq et l'acide H3O+aq.
3.3 Au cours du titrage, la conductivité de la solution évolue. Justifier l'allure de la courbe avant et après l'équivalence.
Avant l'équivalence, H3O+aq est est défaut.
On ajoute des ions chlorure et il se forme des ions ammonium : la conductivité de la solution croît.
Après l'équivalence, H3O+aq est est excés.
On ajoute des ions chlorure et des ions H3O+aq ( de conductivité molaire ionique très importante ) : la conductivité de la solution croît plus rapidement.
3.4. Déterminer le pourcentage massique d'ammoniac contenu dans la bouteille . Commenter.
Quantité de matière d'ammoniac : Véq * c = 19 *0,10 =1,9 mmol dans 100 mL de solution S ( dans 10 mL de liquide d'entretoen).
Concentration de l'ammoniac dans le liquide d'entretien : 1,9 / 10 = 0,19 mol / L.
M(NH3) = 14 +3 = 17 g / mol.
Concentration massique d'ammoniac dans le liquide d'entretien : 0,19 *17 =3,23 g / L
Masse d'un litre de liquide d'entretien : 1102 g.
Teneur massique en ammoniac : 3,23 / 1102 ~0,0029 ( 0,29 %).
Cette valeur étant comprise entre 0,1 et 0,5 %, le flacon de liquide d'entretien n'a pas encore été ouvert.
|
|