Le
pomelo, pHmétrie, dosage par étalonnage, bac Métropole 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
..
..
|
.
.
|
..
..
......
...
|
Cet agrume est connu pour sa teneur élevée en acide ascorbique ( vitamine C).
1. Acidité titrable d'un jus de pomelo.
Le jus de pomelo est acide. Cette acidité est due à l'acide citrique,
le plus abondant, l'acide malique et l'acide ascorbique, présents en
plus faible quantité. On considère, afin de comparer plus facilement
l'acidité entre agrumes, que le seul acide présent dans le jus de
pomelo est l'acide citrique, un triacide noté H3A.
L'acidité titrable est la masse ( en g) d'acide citrique par litre de
jus extrait de l'agrume. Celle d'un jus de pomelo est de l'ordre de la
dizaine de grammes d'acide citrique pour un litre de jus.
On réalise un titrage acido-basique de 20,0 mL de jus frais par une
solution d'hydroxyde de sodium à 0,50 mol / L. On suit le titrage par
pHmétrie.
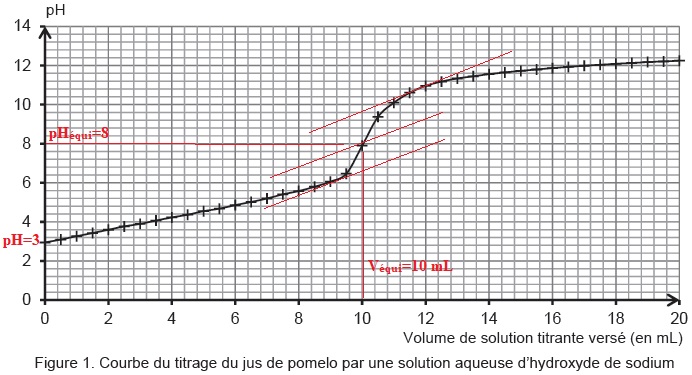
1.1 Déterminer graphiquement la valeur du pH du jus de pomelo.
pH = 3. Ce jus est très acide.
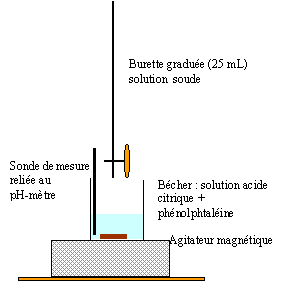
1.2. Schématiser et légender le montage du titrage.
 1.3. Titrage suivi par colorimétrie.
1.3. Titrage suivi par colorimétrie.
1.3.1. Choisir l'indicateur coloré qui peut convenir en justifiant. Préciser le changement de couleur observé.
La zone de virage de l'indicateur coloré doit contenir
le pH du point équivalent ( 8 dans ce cas) : la phénolphtaléine
convient ainsi que le rouge de crésol dont la zone de virage est [7,2 ;
8,8] .
Le rouge de crésol passe du jaune ( milieu acide) au rouge ( milieu basique).
1.4. Déterminer l'acidité titrable du jus de pomelo. Commenter.
H3A aq+ 3 HO-
aq= A3- aq+ 3H2O(l).
Quantité de matière à l'équivalence :
n(HO-) = 0,50 x 0,010 =5 10-3 mol.
n(H3A) = 5 10-3 / 3 =1,67 10-3 mol dans 20 mL de jus.
Concentration en acide citrique : 1,67 10-3 / 0,020 =8,3 10-2 mol / L.
M(acide citrique) = 192 g / mol.
Titre massique en acide citrique : 0,083 x192 ~16 g /L, en accord avec le texte.
2. Détermination de la quantité d'acide ascorbique dans un jus de pomelo.
Il est conseillé à un adulte d'ingérer environ 100 mg par jour d'acide ascorbique ou vitamine C.
On fait réagir l'acide ascorbique présent dans un jus de pomelo avec un
excès de diiode en quantité connue, puis on détermine la quantité de
diiode restante.
On mélange 5,0 mL de ce jus avec 5,0 mL de solution aqueuse de diiode à 8,0 10-3 mol / L. Après quelques instants, l'intensité de la couleur du mélange ne varie plus. On note F ce mélange final de 10,0 mL.
C6H8O6 aq + I2 aq +2H2O(l) ---> C6H6O6 aq +2I-aq +2H3O+aq.
Dosage du diiode restant : gamme d'étalonnage et spectrophotométrie.
Absorbance du mélange final F: A = 0,11.
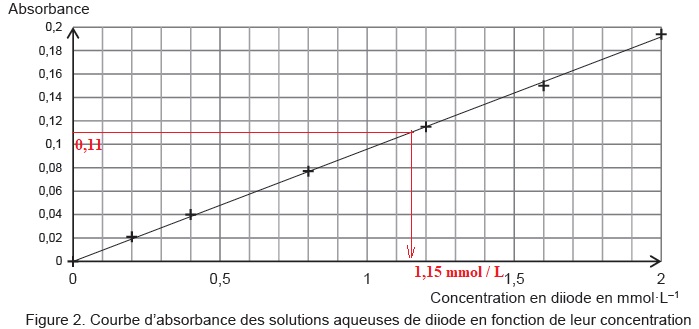
2.1.
Déterminer la valeur de la concentration en quantité de matière de
diiode restant dans le mélange final Fet en déduire la quantité de
matière de diiode ayant réagi avec l'acide ascorbique du jus.
1,15 mmol / L soit1,15 x0,010 = 1,15 10-2 mmol dans 10 mL de F.
Quantité de matière initiale de diiode : 8,0 10-3 x 5,0 10-3 =4,0 10-5 mol.
Quantité de matière diiode ayant réagi : (4-1,15 ) 10-5 =2,85 10-5 mol.
Quantité de matière d'acide ascorbique : 2,85 10-5 mol
2.2. Montrer que la valeur de la concentration en acide ascorbique du jus est d'environ 6 10-3 mol / L.
2,85 10-5 mol dans 5,0 mL soit : 2,85 10-5 / 0,0050 ~5,7 10-3 mol / L
2.3 Calculer le volume de jus de pomelo nécessaire pour couvrir les besoins quotidien en acide ascorbique. Commenter.
M(acide ascorbique) =176 g / mol.
Titre massique en acide ascorbique : 5,7 10-3 x176 =1, 0 g / L.
100 mg dans 0,10 L de jus. C'est tout à fait réalisable.
|