Préparation
d'une bière brune aromatisée, bac Centres étrangers 2021.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts..
...
.
|
.
.
|
..
..
......
...
|
Exercice1 ( 10 points).
Partie 1. Synthèse d'un ester au laboratoire.
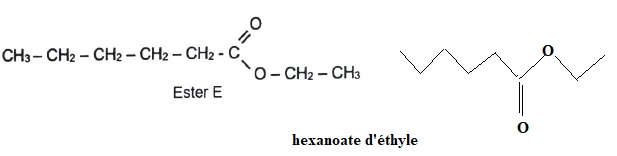
L'ester est noté E. On donne sa formule semi-développée.
1. Nommer E et représenter sa formule topologique.
2. Ecrire
les formules semi-développées de l'acide carboxylique A et de l'alcool
B intervenant dans la synthèse de E. Nommer chacun d'eux.
CH3-CH2-CH2-CH2-CH2-COOH acide hexanoïque
CH3-CH2OH éthanol.
Pour obtenir E, on chauffe à reflux un volume d'alcool Valcool = 20,0 mL avec un volume d'acide carboxylique Vacide = 43,0 mL en présence d'acide sulfurique. On obtient mE = 33,1 g d'ester E.
3. Justifier le double intérêt du chauffage à reflux.
La température est un facteur cinétique. En travaillant à température
modérée, on accélère la réaction en évitant les pertes de matière. Les
vapeurs se condensent dans le réfrigérant et retombent dans le milieu
réactionnel.
4. L'acide sulfurique est un catalyseur. Citer la définition d'un catalyseur.
Un catalyseur augmente la vitesse de la réaction. La composition du mélange à l'équilibre n'est pas modifiée.
Le catalyseur intervient lors d'une étape de la réaction et se trouve régénéré lors de la dernière étape.
5. Montrer que les réactifs sont en proportions pratiquement stoechiométriques et calculer le rendement de cette synthèse.
Acide A : masse volumique 0,930 g / mL.
Masse = 0,93 x 43,0 =39,99 g.
M(acide) = 116,2 g /mol ; n(A) = 39,99 / 116,2 ~0,344 mol.
Alcool B : mase volumique ; 0,789 g / mL.
masse : 0,789 x 20,0 =15,78 g.
M(B) = 46,1 g / mol ; n(B) ~0,342 mol.
Quantité de matière d'ester si la réaction est totale : 0,34 mol.
M(E) =144,2 g / mol.
Mase théorique d'ester = 0,34 x144,2 ~49,4 g.
Rendement = masse réelle / masse théorique = 33,1 / 49,2 ~0,67 ( 67 %).
Pour améliorer le rendement, on réalise trois synthèses en faisant
varier différents paramètres. Pour chaque synthèse, un suivi temporel
de la concentration en acide carboxylique est réalisé par titrage.
|
Volume d'acide (mL)
|
volume d'alcool (mL)
|
catalyseur
|
température (°C)
|
synthèse 1
|
43
|
20
|
oui
|
50
|
synthèse 2
|
43
|
25
|
oui
|
50
|
synthçse 3
|
43
|
20
|
oui
|
70
|
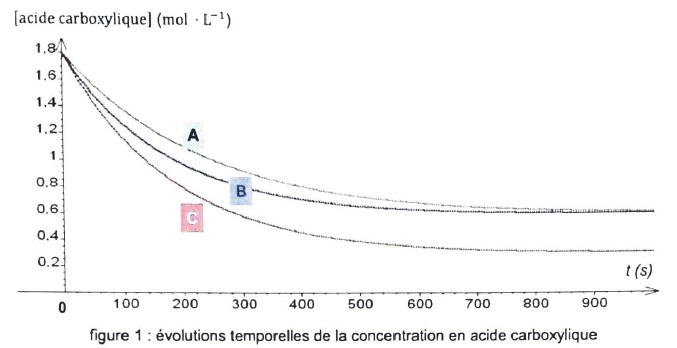
6.
Identifier les conditions expérimentales, en précisant le numéro de la
synthèse, pour lesquelles la réaction est la plus lente. Préciser la
courbe associée.
Courbe A et synthèse 1 : proportions stoechiométriques, catalyseur et température de 50°C.
7.
Identifier les conditions expérimentales, en précisant le numéro de la
synthèse, pour lesquelles le rendement de la réaction est amélioré. Préciser la
courbe associée.
Courbe C et synthèse 2 : alcool en excès, catalyseur et température de 50°C. ( il reste peu d'acide carboxylique à l'équilibre).
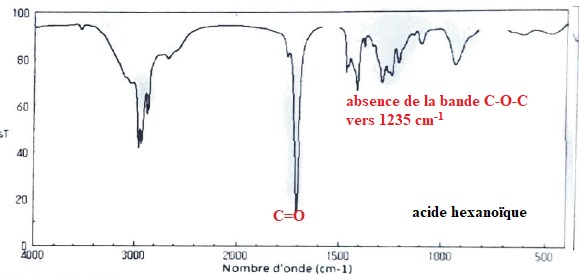
On
donne les spectres infrarouge de chacun des réactifs avant la synthèse
et du produit organique isolé et purifié après la synthèse.
8. Identifier celui de l'ester en justifiant.
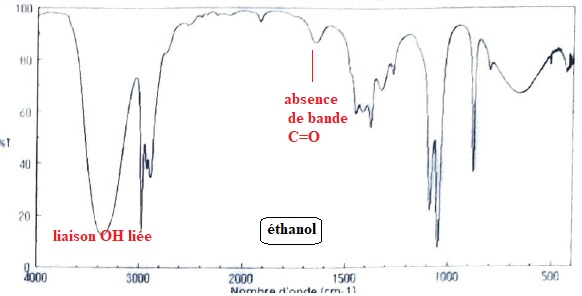
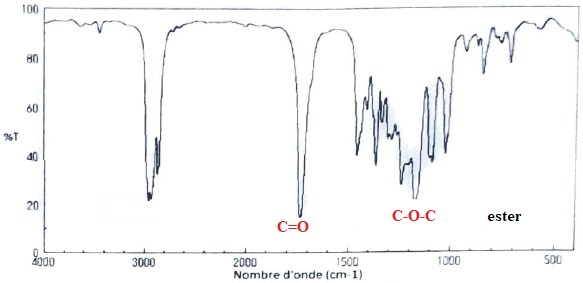
|
...
|
....
|
Etude de l'eau de brassage d'une bière brune.
L'eau utilisée doit contenir des ions chlorure à une concentration massique comprise entre 100 mg et 200 mg / L.
On souhaite savoir si une eau de source peut convenir au brassage. On
titre les ions chlorure de cette eau par une solution de nitrate
d'argent. Le titrage est suivi par conductimétrie.
Il faut que la transformation associée au titrage soit rapide et totale. Pour cela on mélange dans un tube à essai :
V1 =2,0 mL de solution aquueuse de chlorure de sodium de concentration C1 =0,050 mol/L et V2=2,0 mL de solution aqueuse de nitrate d'argent de concentration C2=0,0425 mol / L.
On observe la formation immédiate d'un précipité blanc, de chlorure d'argent.
Ag+aq +Cl-aq --> AgCl(s). k = 6,4 109.
9. Montrer qu'à l'équilibre, l'avancement xéq peut être déterminé par la résolution de l'équation :
K = (V1+V2)2 / ((V1C1-xéq)(V2C2-xéq)).
K = 1 /([Ag+]éq [Cl-]éq).
[Ag+]éq= (V2C2-xéq) / (V1+V2).
[Cl-]éq= (V1C1-xéq) / (V1+V2).
Les solutions de cette équation sont :
x1 = 1 10-4 mol et x2 =8,5 10-5 mol.
Quelle solution doit être retenue ?
V1C1 =2,0 x0,05 10-3 =1 10-4 mol.
V2C2 =2,0 x0,0425 10-3 =8,5 10-5 mol.
xéq < 8,5 10-5 mol. ( on retient x2).
10. Cette transformation est-elle adaptée au titrage des ions chlorures.
Oui, la trasformation est totale ( tous les ions chlorure ont réagi ) et de plus rapide.
Dosage par titrage de l'eau de source.
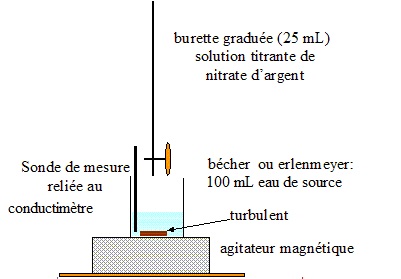
On prélève un volume V1 = 100,0 mL d'eau de source que l'on
introduit dans un grannd becher dans lequel on plonge une cellule
conductimétrique. A l'aide d'une burette graduée, on ajoute
progressivement une solution aqueuse de nitrate d'argent de
concentration C3 = 1,00 10-2 mol/ L.
11. Faire un schéma légendé du dispositif utilisé lors de ce titrage.
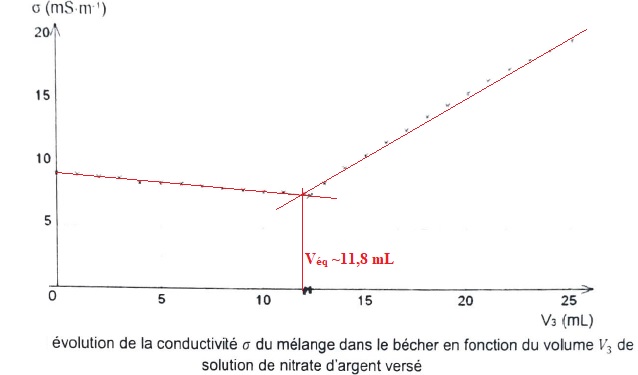
2. Justifier l'allure de la courbe.
L'ion
argent est en défaut avant l'équivalence ; du point de vue de la
conductivité, tout revient à remplacer l'ion chlorure par l'ion nitrate
de conductivité molaire ionique un peu plus faible.
La conductivité, et en conséquence la conductance de la solution diminue lentement.
- l'augmentation de la conductance G après l'équivalence.
L'ion
argent est en excès après l'équivalence. On ajoute des ions argent et
nitrate à la solution. La conductivité de la solution va croître assez
vite.
13. Indiquer si la teneur en ion chlorure de cette eau peut convenir pour la fabrication de la bière.
A l'équivalence : [Cl- ] V1 = Véq C3;
[Cl- ] V1 = Véq C3 / V1 =11,8 x 1,00 10-2 / 100 =1,18 10-3 mol / L.
Titre massique en ion chlorure : 1,18 10-3 M(Cl) =1,18 10-3 x35,5 = 4,19 10-2 g / l ( ~42 mg / L).
Cette valeur n'étant pas comprise entre 100 et 200 mg/L, cette eau de source ne convient pas.
|
|