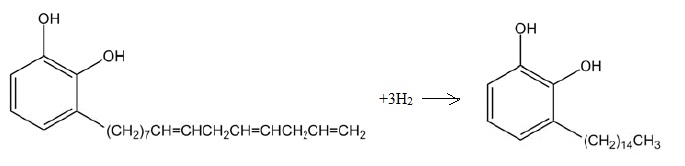Se
défendre dans le monde végétal et animal, Capes physique chimie 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
Se défendre dans le monde végétal.
Dans le monde végétal, les plantes se sont
dotées d’un système de défenses biologiques, physiques et chimiques
pour lutter contre toute forme d’agression.
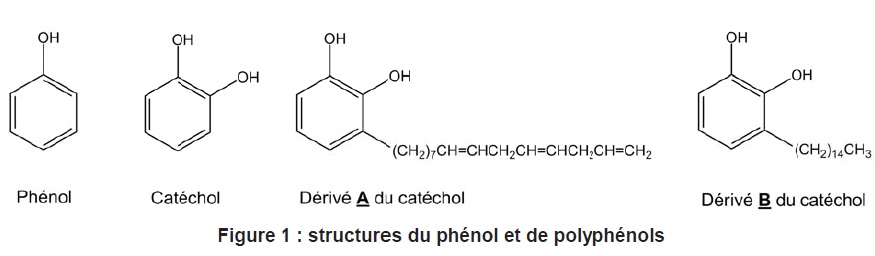
A. L’urushiol est
une toxine organique que l'on trouve dans une plante d’Amérique du
Nord, le sumac grimpant. L’urushiol est constitué d’un ensemble de
molécules dérivées du catéchol (ortho-diphénol ou benzène-1,2-diol)
dont A et B représentés. La présence
des groupements hydroxyle dans ces dérivés est à l’origine d’allergies
et de dermatites par contact cutané.
Q1. Expliquer la différence de pKa entre les couples phénol /
ion phénolate pKa = 10 et cyclohanol / io cyclohexcanolate pKa = 16.
L'ion phénolate est stabilisé par résonance : la charge portée par
l'oxygène est délocalisée sur le cycle benzénique. l'hydrogène du
groupe OH du phénol est donc plus acide que l'hydrogène du groupe
hydroxyle du cyclohexanol.
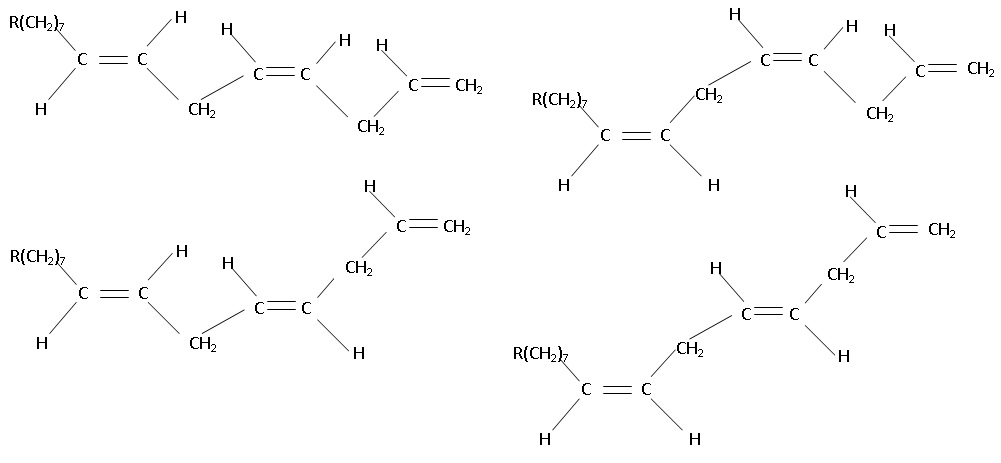
Q2. Quel est le
nombre maximal de stéréoisomères de configuration du dérivé A du
catéchol ? Justifier.
La double liaison CH=CH2 ne présente pas d'isomérie Z / E.
Q3.
Proposer un réactif et un catalyseur permettant de transformer A en B.
Ecrire l'équation de la réaction modélisant cette transformation. Parmi
les termes suivants quels sont ceux qui caractérisent cette
transformation chimique : insertion, élimination, substitution,
addition, réarrangement, oxydo-réduction, acido-basique.
Addition du dihydrogène ( oxydo-réduction ) sur les trois liaisons
doubles C=C en présence de palladium ( haute pression et température élevée) Le cycle n'est pas réduit.
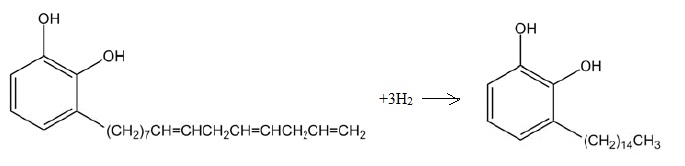
Q4. Pour quelle
raison la température de fusion du catéchol ( 105 °C sous 1 bar )
est-elle plus faible que celle de son isomère le para-diphénol ( 172°C
sous 1 bar ).
Présence de liaisons hydrogène intramoléculaires dans le catéchol.
B. Les plantes
carnivores ont la capacité à attirer, capturer et digérer leurs proies.
( sources complémentaires d'azote, de phosphore, de soufre, de
magnésium et de potassium ). Ces plantes poussent la plupart du temps
dans des sols pauvres en azote, en phosphore et en potassium.
On se propose de doser la teneur en élément potassium dans un sol
d'Amazonie par la méthode des ajouts dosés. La spectrophotométrie de
flamme par absorption atomique permet de quantifier la présence de
l'élément potassium.
Q5. La teneur en
élément potassium dans ce sol est-elle en accord avec la présence
d'une plante carnivore ?
Méthode
des ajouts dosés.
La méthode des ajouts dosés consiste à réaliser une gamme d’étalonnage
avec une solution étalon (E) de chlorure de potassium (la concentration
massique en ions K+ est CE = 1,0 mg.L-1)
et la solution à doser (S).
- Placer 1,0 kg de terre d’Amazonie prélevée sous des plantes
carnivores dans un bécher contenant 1 litre d’eau.
- Après agitation, filtrer et essorer les particules solides.
- Récupérer le filtrat dans une fiole jaugée de 1,0 L et ajuster au
trait de jauge avec de l’eau déminéralisée. On appelle (S) la solution
ainsi obtenue contenant les ions potassium à la concentration massique CK.
- Préparer 5 fioles jaugées de 50,0 mL, verser dans chacune d’elles les
volumes de solutions (S) et (E) indiqués dans le tableau ci-dessous, et
compléter avec de l’eau déminéralisée :
Fiole
n°
|
0
|
1
|
2
|
3
|
4
|
Volume
de solution S en mL
|
1,0
|
1,0
|
1,0
|
1,0
|
1,0 |
Volume
de la solution E, en mL
|
0.
|
2;5
|
5;0
|
7;5
|
10
|
- Réaliser les mesures sur chaque fiole de la gamme étalon. Le
spectrophotomètre de flamme fournit une réponse, sans unité, notée ri
dont la valeur est proportionnelle à la quantité d’ions potassium : ri
= a (CEi + CS) avec CEi la
concentration massique en ions
potassium dans la fiole « i », issus de la solution étalon (E) et CS
la concentration massique en ions potassium dans les fioles, issus de
la solution (S).
ri = a CEi + a CS avec a CS une constante.
Fiole
n°
|
0
|
1
|
2
|
3
|
4
|
Réponse
ri
|
45
|
52
|
59
|
66
|
74
|
CE (mg / L)
|
0
|
2,5 /50 =0,05
|
5 / 50=0,10
|
7,5 / 50=0,15
|
10 / 50 =0,20
|
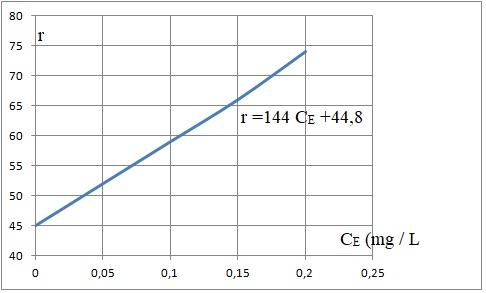
a = 144 et aCS = 44,8 ; CS = 44,8 / 144 = 0,31 mg / L soit 3 10-4 g d'élément potassium par kg de terre.
CS est inférieure à 0,02 g / kg de terre en
élément potassium : la teneur en élément potassium est faible.
|
...
|
|
|
....
|
Se défendre dans le monde animal.
L'insecte de cochenille Dactylopius caccus est élevée sur les
cactus du Mexique. Les femelles sontt récoltées juste avant qu'ells ne
pondent car à ce stade elles contiennent la plus grande quantité
d'acide carminique présent sous forme de sel de potassium.
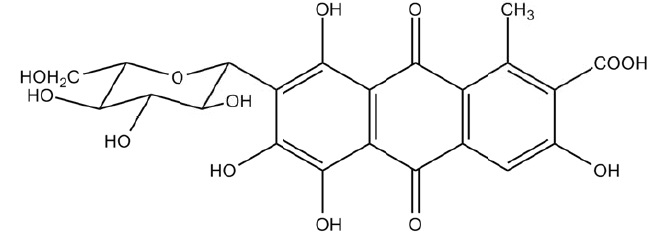
L'acide carminique est le seul colorant d'origine animale autorisé dans
l'industrie alimentaire ( E 120). Il est précisésur les emballages, si
cet acide est d'origine naturelle ou synthétique.
Q6.
Proposer en 10 lignes maximum, une introduction à la partie "couleurs
et arts" du programme de première L / ES. Cette introduction, en lien
avec l'histoire des sciences, citera quelques repères chronologiques et
se conclura par une problèmatique adaptée.
L'homme de la préhistoire utilise l'ocre, une roche ferrique rouge, dans les peintures rupestres.
Dans l'Antiquité on utilise certaines plantes ( garance ( rouge) , indigotier ( bleu), henné ( brun).
Au moyen âge, on utilise des pigments bleus ( roche azurite).
L'essor des colorants de synthèse débute en 1856 avec la synthèse de la mauvéine.
Aujourd'hui la plupart des colorants industriels sont synthétiques.
La couleur joue un rôle essentiel en Art. Elle résulte de l'utilisation de pigments et de colorants.
La lumière blanche émise par le soleil contient toutes les couleurs de l'arc en ciel.
L'addition des trois couleurs primaires ( bleu, vert, rouge) donne le
blanc ( synthèse additive, principe de base du fonctionnement des
écrans ).
On peut soustraire des couleurs à la lumière blanche en utilisant des
filtres. La synthèse soustractive est le principe de base en impression
et en peinture qui utilisent un support blanc.
Comment est définie la couleur d'un objet ?
Elle dépend de la matière ( colorants et pigments ) et de la lumière qui l'éclaire.
Q7. En
écrasant des cochenilles séchées avec un pilon et un mortier en
présence d'eau, on récupère après filtration une solution aqueuse de pH
= 6. Proposer un protocole expérimental permettant d'isoler l'acide
carminique à l'état solide à partir de cette solution.
L'acide carminique est peu soluble dans l'eau ( 1,3 g / L à 25°C ).
En milie acide ( pH ~ 1) la forme RCOOH est majoritaire et le solide précipite. Filtrer ensuite.
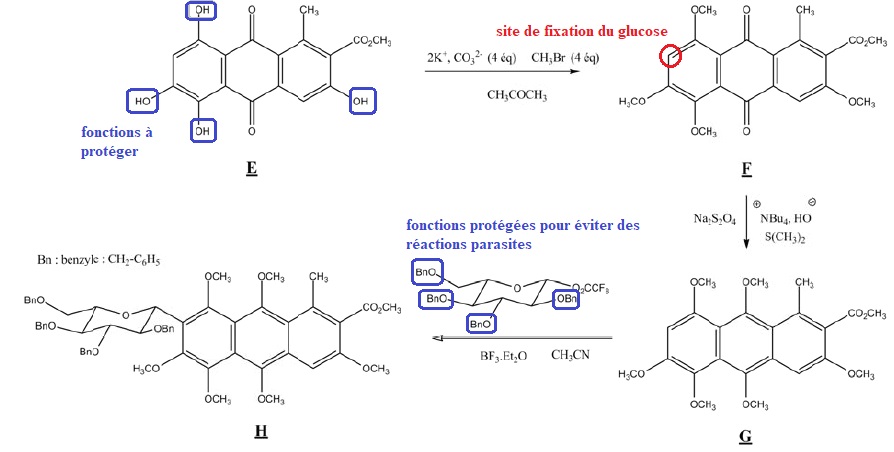
Trois étapes de la synthèse de l'acide carminique sont décrites.
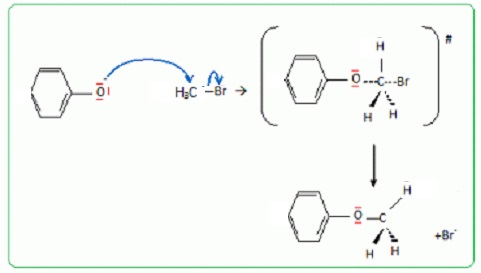
Q8. On s'intéresse
à l'étape de protection des fonctions phénol du substrat E. Quel est le
rôle de chacune des espèces chimiques : ( 2K+, CO32-), CH3Br et CH3COCH3 permettant la transformation de E en F ?

( 2K+, CO32-) : en milieu basique de phénol est sous forme d'ion phénate.
CH3COCH3 : solvant. CH3Br fournit le groupe méthyle.
Q9. Ecrire le mécanisme de la transformation de E en F. Le substrat E sera modèlisé par le phénol.
Substitution nucléophile SN2.
En milieu basique la fonction phénol se trouve sous forme d'un ion phénate.
Q10. L'acide
carminique possède un cycle glucosidique. Comment appelle-t-on la
transformation chimique de G en H ? Repérer le site électrophile, le
site nucléophile, le solvant, le catalyseur. Ecrire la formule
semi-développée du sous produit de cette réaction.
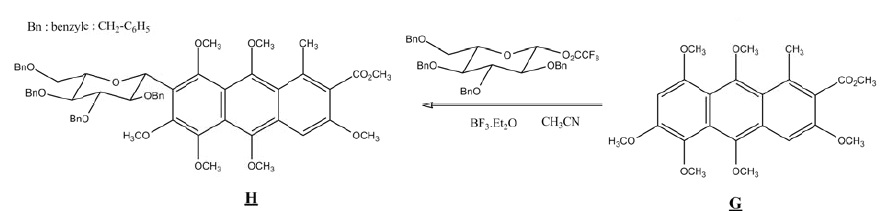
Substitution électrophile sur le cycle benzénique ( site nucléophile).
Solvant : acétonitrile CH3CN ; catalyseur BF3Et2O.
Q11. Indiquer en justifiant, parmi les signaux a, b, cet d du spectre RMN13C le signal correspondant au solvant, puis attribuer les 3 autres signaux restant aux atomes de carbone de l'acide carminique.
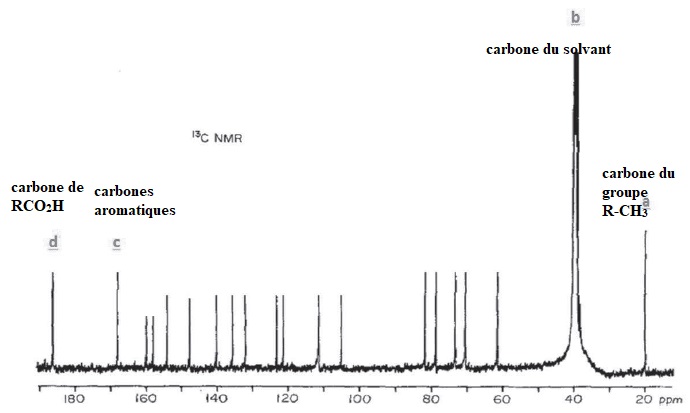
Q12. Que signifie l'expression DMSO-d6 ? Pourquoi le spectre RMN 13C de l'acide carminique dans le DMSO-d6 n'est constitué que de singulets ?
Diméthylsulfoxylde hexadeutéré.
Abondance du carbone 13 ( ~1%). La probabilité d'avoir deux atomes de
carbone 13 voisins, donc couplés est si faible que le spectre se
présente sous forme de singulets.
Q13. Comment le
professeur peut-il exploiter cette suite de réactions pour illustrer le
programme de terminale S relatif à la protection en synthèse peptidique.
Une fonction amine réagit avec une fonction acide carboxylique en synthèse peptidique.
Toutes les autres fonctions doivent être protégées afin d'éviter des réactions parasites..
Dans le cas de la synthèse de l'acide carminique indiquer :
le site de fixation du glucose ;
les fonctions à protéger sur le substrat E ;
les fonctions du glucose pouvant induire des réactions parasites.
En cas de stress, les coléoptères bombardiers expulsent au niveau de
l'abdomen 1 mg d'une solution aqueuse brûlante ( mélange de composés
issus d'une réaction entre l'hydroquinone QH2 et le peroxyde d'hydrogène H2O2). Il se forme la quinone Q et de l'eau. ( réaction a).
Simultanément et instantanément, d'autres enzymes catalyse la réaction
de décomposition du peroxyde d'hydrogène en dioxygène gazeux ( réaction
b).
Q14. Donner les deux équations de réaction a et b.
QH2 aq +H2O2 aq ---> Q aq + 2H2O(l).
2H2O2 aq --->O2(g) +2H2O(l).
Q15. Evaluer la température du liquide éjecté par le coléoptère. CQH2 = 1 mol / L et CH2O2 =2 mol / L.
La densité de la solution aqueuse est voisine de celle de l'eau.
Volume de la solution réactive : V = 1,0 10-3 / 1000 = 1,0 10-6 L.
Quantités de matière initiales des réactifs :
n(H2O2) =2 x 10-6 mol ; n(QH2) =1 x 10-6 mol ( en défaut).
Quantités de matière finale des produits : n(Q) = 1,0 10-6 mol ; n(H2O) = 2,0 10-6 mol.
L'excès d'eau oxygénée réagit entièrement et conduit à 0,5 10-6 mol de dioxygène et 1,0 10-6 mol d'eau.
Enthalpie standard de réaction à 298 K :
(1) : QH2aq = Q aq +H2(g) ; 178 kJ/mol.
(2) : H2(g) + O2(g) = H2O2(aq) ; -191 kJ/mol.
(3) : H2(g) +½O2(g) = H2O(l) ; -285 kJ /mol.
Réaction (a) soit (1) -(2) +2(3) :178 +191 +2(-285) = -201 kJ / mol.
Réaction (b) soit -2(2) ++2 (3) : 2 (191-285)= -188 kJ / mol.
Energie libérée par ces réactions exothermiques :
Réaction (a) : -201 x1,0 10-6 = -2,01 10-4 kJ = -0,201 J.
Réaction (b) : -188 x 0,5 10-6 = -0,094 10-4 kJ = -0,094 J.
Total : Q =-0,295 J.
Elévation de la température de la solution aqueuse initialement à 20°C :
Dq = |Q| / mceau = 0,295 / (1,0 10-3 x4,18) ~ 71°C.
Tfinale = 71 +20 = 91 °C.
Q16. En terminale S un élève suggère : " je pense qu'un catalyseur permet d'augmenter le rendement d'une réaction"
Décrire une expérience permettant de vérifier cette hypothèse.
Problématique : quel est le rôle d'un catalyseur en chimie ?
Expérience : éthanol + acide acétique = éthanoate d'éthyle + eau.
8 groupes d'élèves : 4 groupes utilisent quelques gouttes d'acide sulfurique en tant que catalyseur.
Chaque groupe répartit le mélange réactionnel dans 8 tubes à essais numérotés de 1 à 8.
Porter les huit tubes à essais numérotés au bain marie à 70°C.
Toutes les 5 minutes on prélève l'un des tubes que l'on place dans un bain de glace.
L'acide restant est dosé par la soude ( indicateur : phénolphtaléine) afin de suivre l'avancement.
Graphique à construire : rendement = f(temps).
Conclusion : pour tous les groupes, le rendement tend vers 0,67.
Mais en présence d'acide sulfurique, le rendement est plus rapidement atteint.
|
|