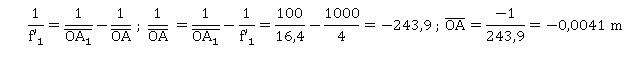Dosage
du fer par colorimétrie, microscope, Analyse de biologie médicale 2018.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
Le fer
dans le plasma.
On réalise à 20°C, une solution aqueuse tamponnée à pH = 7 de
concentration en soluté apporté en ion fer (III) égale à 2,0.10-5
mol.L-1. On observe la formation d’un précipité d’hydroxyde
de fer (III).
Q1. Écrire la
réaction de précipitation de l’hydroxyde de fer (III).
Fe3+ aq + 3HO- aq = Fe(OH)3 (s).
Q2. Donner
l’expression du produit de solubilité de l’hydroxyde de fer (III) en
fonction des concentrations mises en jeu.
Ks = [Fe3+ ] [HO- ]3 = 4,0 10-38
à 20°C.
Q3. Montrer
quantitativement qu’il était possible de prévoir la formation de
l’hydroxyde de fer(III).
[Fe3+ ] [HO- ]3
=2,0 10-5 x( 10-7)3 = 2,0 10-26,
valeur supérieur à Ks, l'hydroxyde précipite.
La concentration en ion
fer (III) dans le plasma est d’environ 2,0.10-5 mol.L-1.
Le plasma sanguin contient aussi une protéine appelée transferrine,
notée Tr. Cette protéine est capable de complexer les ions ferriques
selon la réaction:
Tr + Fe3+ --> [FeTr]3+.
La constante de formation du complexe à 20°C [FeTr]3+ vaut
Kf = 1024.
Q4. La
transferrine, si elle est en quantité suffisante, permet d’éviter la
formation d’hydroxyde de fer (III). Justifier cette affirmation. Aucun
calcul n’est demandé. On négligera l’influence éventuelle de la
température..
Kf est très grande, la réaction de complexation du fer(III) est totale.
La concentraion en ion fer (III) résiduel est très faible et Ks ne peut
plus être atteint. L'hydroxyde ne précipite pas.
Dosage du fer sérique par
colorimétrie.
Le fer sérique correspond à l’élément fer en circulation libre dans le
plasma sanguin et non fixé à l'hémoglobine des globules rouges. Sa
concentration normale est comprise entre 10 µmol.L-1 et 30
µmol.L-1. À l’état normal, le fer sérique est, pour sa
quasi-totalité, sous forme d’ions ferriques Fe3+ liés à la
transferrine, protéine capable de complexer les ions Fe3+
selon la réaction : Tr + Fe3+ ---> [FeTr]3+.
À pH = 5 et en présence de guanidine les ions Fe3+ sont
libérés de la transferrine. Sous l’action de l’hydroxylamine, ils sont
réduits en fer (II) qui forme alors un complexe coloré avec la
ferrozine.
[FeTr ]3+ ---> Fe3+ (1).
Fe3+ ---> Fe2+ (2).
Fe2+ ---> complexe coloré (3).
On considèrera que la totalité des ions Fe3+ présents dans
le plasma contribue à la formation du complexe coloré à l’issue de la
réaction 3 (les trois réactions sont considérées comme totales).
Première
partie : choix de la solution tampon.
Ce kit nécessite de travailler en milieu tampon pH = 5
Q5. Donner les
propriétés d’une solution tampon.
Une solution tampon modère les variations de pH suite à l'ajout modéré
d'un acide fort ou d'une base forte, ainsi que lors d'une dilution
modérée.
On dispose au laboratoire d’une solution d’ammoniaque (NH3)
à 0,10 mol.L-1, d’une solution d’acide éthanoïque (CH3COOH)
à 0,10 mol.L-1, d’une solution d’acide chlorhydrique (H3O+,Cl-)
à 0,20 mol.L-1 et d’une solution d’hydroxyde de sodium (Na+,HO-)
à 0,20 mol.L-1 ainsi que d’un pH mètre.
Q6. Parmi les
quatre solutions aqueuses dont on dispose, citer, en justifiant, les
deux qui sont nécessaires à la réalisation d’une solution tampon de pH
= 5 et proposer sans aucun calcul un protocole expérimental pour la
réalisation de ce tampon.
Titrage de la solution d'acide éthanoïque ( prise de 20,0 mL située
dans le becher ) par la solution d'hydroxyde de sodium ( solution
dans la burette) avec arrêt lorsque le pH est égal à 5.
Deuxième
partie : détermination de la concentration en fer sérique d’un patient.
La ferrozine est un ligand noté L2- à pH = 5. Il faut trois
ligands ferrozine pour complexer un ion Fe2+.
Q7. Écrire
l’équation de formation du complexe fer-ferrozine.
Fe2+ + 3L2- ---> Fe(L)34-.
Dans la notice du « ferrimat kit », la longueur d’onde utilisée pour le
dosage est fixée à 562 nm, longueur d’onde pour laquelle l’absorbance
du complexe est maximale.
Q8. Énoncer une
raison qui justifie de choisir comme longueur d’onde de travail, celle
pour laquelle l’absorbance est maximale.
Pour une meilleure précision, on choisit la longueur d'onde
correspondant au maximum d'absorption.
On réalise le dosage sérique d’un patient selon
le mode opératoire manuel.
Dans la rubrique performance de la méthode, il est indiqué « La méthode
analytique est linéaire pour des concentrations en fer comprises dans
l’intervalle 4 µmol.L-1- 180 µmol.L-1 ». Dans ces
conditions, le kit précise que la relation qui permet d’accéder à
la concentration en fer sérique du patient Cpatient est donnée par :
Cpatient = (Aéch -Ablanc éch) / Aétal
x Cétal.
On rappelle que C étal = 2,00 mg / L est la concentration
en fer dans l’étalon.
Les résultats obtenus sont les suivants :
Absorbance de la solution « blanc échantillon »: Ablanc éch
= 0,008
Absorbance de la solution « échantillon » : Aéch = 0,115
Absorbance de la solution « étalon » : Aétal = 0,164
Q9. En utilisant la
loi de Beer-Lambert, établir la relation ci-dessus.
L'absorbance A est proportionnelle à la concentration C..
Aéch-Ablanc éch = k Céchantillon
(1) avec k une constante.
Aétal = k Cétal.(2)
(1) / (2) donne : (Aéch -Ablanc éch) / Aétal
= Céchantillon / Cétal.
Par suite : Cpatient = (Aéch -Ablanc
éch) / Aétal x Cétal.
Q10. La
concentration en fer sérique du patient est-elle située dans la gamme
des concentrations normales ? Justifier.
Cpatient = (0,115 -0,008) / 0,164
x2,00 =1,30 mg / L.
1,30 10-3 / M(Fe) = 1,30 10-3 / 55,8 = 2,3 10-5
mol/ L = 23 µmol / L, valeur comprise entre 10 et 30 µmol/ L.
La concentration est normale.
|
...
|
|
|
....
|
Détection de la drépanocytose
La drépanocytose est une maladie génétique caractérisée par une
anomalie de l’hémoglobine contenue dans les globules rouges. La maladie
peut être à l’origine d’une anémie parfois importante, nécessitant des
transfusions sanguines. Ces transfusions, si elles sont nombreuses,
sont elles-mêmes responsables à long terme d’une accumulation de fer
dans le foie et la rate.
Chez les personnes atteintes de drépanocytose, l'hémoglobine est
anormale. Quand la concentration en dioxygène du sang diminue, elle
déforme les globules rouges (ou hématie) qui prennent alors la forme de
faucilles, au lieu d'être biconcaves. La taille d’une hématie «
biconcave est d’environ 8 µm, celle d’une « faucille » est d’environ 12
µm. La détection de cette maladie peut se faire par observation de
cellules
sanguines au microscope.
Première partie :
microscopie électronique.
Le principe général de fonctionnement d’un microscope électronique est
le même que celui d’un microscope optique : l’objet à analyser est
éclairé et des lentilles permettent de grossir son image. Mais au lieu
d’éclairer avec de la lumière, le microscope électronique utilise un
faisceau d’électrons produit par un canon à électrons. Au lieu de
grossir l’image à l’aide de lentilles en verre, il emploie des
lentilles électromagnétiques.
La relation entre la longueur d'onde λ d'une particule de masse m, se
déplaçant avec une vitesse, v, est donnée par l'équation de de Broglie :
l = h
/ (m v).
Q11. Calculer la
longueur d’onde des électrons, en nm, si leur vitesse est de 1,90.108
m.s-1.
l =
6,63 10-34 /(9,109 10-31 x1,90 108)
=3,83 10-12 m = 3,83 10-3 nm.
Q12. L’ouverture
numérique ON d’un microscope électronique est égale à 0,010.
Justifier que la limite de résolution de l’instrument permet de voir
les hématies et de détecter la drépanocytose.
ABmini =
1,22 l /(2 ON)
=1,22 x3,83 10-12 /0,020 =2,3 10-10 m.
La taille d'une hématie est de l'ordre de 10 µm, valeur bien supérieure
à ABmin. Le microscope électronique permet leur observation.
Seconde partie :
microscope optique.
On souhaite déterminer si la détection de la drépanocytose est possible
avec un microscope optique.
Q13. Le schéma
suivant indique le principe du microscope dans le cas de
l’observation à l’infini (sans accommodation) d’un
objet plan AB perpendiculaire à l’axe optique, A1B1
étant l’image intermédiaire de l’objet AB donné par l’objectif L1.
Compléter ce schéma en indiquant les positions des centres optiques O1
et O2 des deux lentilles L1 et L2 et
les positions de leurs foyers objets et images F1, F1’,
F2 et F2’ respectifs. On précise que ce schéma
n’est pas à l’échelle.
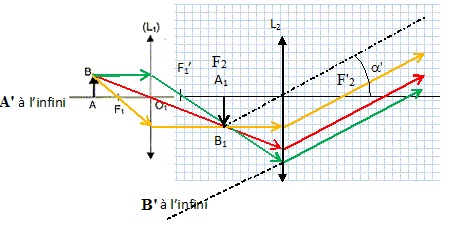
L’oculaire utilisé noté L2 a une distance focale f’2
= 2,50 cm. L’objectif utilisé a une distance focale f’1 =
4,00 mm. L’intervalle optique est de 16,0 cm.
Q14. Montrer que
pour une observation à l’infini l’objet AB doit être placé à 0,410 cm
devant l’objectif.
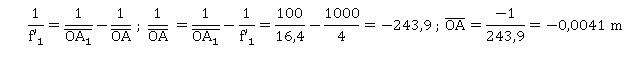
Q15. Calculer le
grossissement commercial Gc de ce microscope.
Le grossissement commercial, Gc, du microscope est défini par : Gc
= q' / q = 0,25 D / (f '1 f' 2).
avec q le
diamètre apparent de l’objet observé à l’oeil nu, à la distance 25 cm
de cet
objet et q' le
diamètre apparent de l’image définitive formée à l’infini.
Gc =
0,25 x 0,160 /( 4,00 10-3 x2,50 10-2) = 400.
Q16. Pourrait-on se
contenter d’un microscope optique pour détecter la drépanocytose ?
Pour répondre à cette question, on tiendra compte du pouvoir séparateur
angulaire de l’oeil et du phénomène de diffraction. On supposera un
microscope éclairé en lumière visible (400 - 800 nm) et dont
l’ouverture numérique ON vaut 0,65. Tout raisonnement cohérent sera
pris en compte.
ABmini
= 1,22 l /(2 ON)
=1,22 x 600 10-9 /1,3 =5,63 10-7 m~0,56 µm,
valeur supérieure à,la taille d'une hématie.
q = AB
/ 0,25 =10 10-6 / 0,25 = 4 10-5 rad.
q' = Gc
q =
400 x 4 10-5 =1,6 10-2 rad, valeur
supérieure au pouvoir séparateur de l'oeil 3 10-4 rad.
L'hématie est observable.
|
|