La
scopolamine,
la leucine, hypergravité, bac St2S Métropole 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
La scopolamine ( 7,5 points).
La
préparation à ce séjour dans l’espace nécessite des phases
d’entraînement intense qui sont à l’origine de nausées. Afin de
minimiser ces désagréments, la prise de scopolamine est utile.
1. Étude de la réaction de
préparation de la scopolamine.
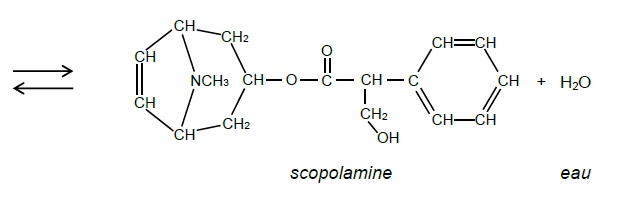
On s’intéresse à l’une des étapes de la préparation de la scopolamine,
décrite par l’équation de la réaction de l’action du tropan-3-ol sur
l’acide tropique illustrée en ANNEXE 1.
1.1. Indiquer sur
l’ANNEXE 1 les noms des deux groupes caractéristiques entourés sur les
formules du tropan-3-ol et de l’acide tropique.
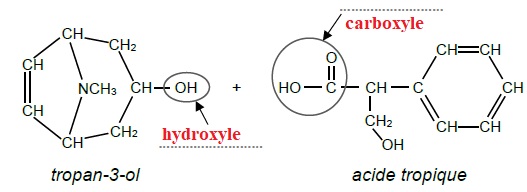
1.2. Donner le nom
de la réaction de préparation de la scopolamine.
Estérification.
1.3. Citer deux
caractéristiques de cette réaction.
Cette réaction est lente, limitée par l'hydrolyse de l'ester.
2. Dosage de la scopolamine.
La scopolamine est injectée sous forme de scopolamine hydrobromide à
une concentration massique Cm égale à 0,4 mg/mL (ou 0,4 mg·mL-1).
2.1. Exprimer la
concentration massique Cm en g·L-1.
0,4 g / L.
2.2. Calculer, à
partir de la valeur de Cm, la concentration molaire C en
scopolamine hydrobromide, exprimée en mol L-1.
La masse molaire M du scopolamine hydrobromide est égale à 438 g·mol-1.
0,4 / 438 =9,13 10-4 ~9 10-4 mol/ L.
2.3. Réalisation du
dosage pH-métrique.
La scopolamine hydrobromide est un mélange équimolaire d’acide
bromhydrique et de scopolamine.
De ce fait, pour déterminer la concentration de scopolamine dans la
solution de scopolamine hydrobromide, on procède au dosage de l’acide
bromhydrique présent dans cette solution.
Voici les étapes de la préparation de ce dosage :
Etape 1 :
On prélève un volume de 10,0 mL de scopolamine hydrobromide issu du
flacon que l’on verse dans une fiole jaugée de 200 mL.
On complète avec de l’eau distillée jusqu’au trait de jauge. On obtient
la solution A dont la concentration CA en acide
hydrobromique est égale à C/20.
Etape 2 :
On dose un volume VA égal à 20,0 mL de la solution acide A
précédente par une solution basique B d’hydroxyde de sodium dont la
concentration CB est égale à 5,0×10-5 mol·L
- 1.
Résultat :
L’équivalence du dosage est atteinte pour un volume versé d’hydroxyde
de sodium VB,E égal à 18,3 mL.
2.3.1. Nommer la technique
opératoire décrite à l’étape 1.
Dilution.
2.3.2. Choisir, en
décrivant la démarche, parmi les deux courbes pH-métriques proposées,
celle qui correspond au dosage réalisé.
La solution acide titrée se trouve dans le becher ; le pH initial est
inférieur à 7.
Après l'équivalence, la solution de soude est en excès et le pH est
bien supérieur à 7.
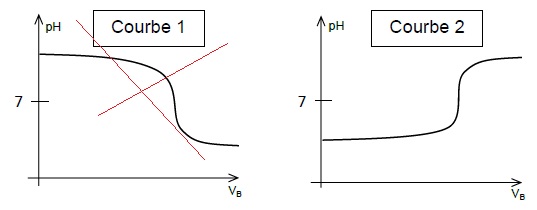
2.3.3. Vérifier, en
expliquant la démarche utilisée, que la concentration CA est
voisine de 4,58 × 10-5 mol / L.
A l'équivalence CA = CB VBE / VA
=5,0 10-5 x18,3 / 20,0 =4,58 × 10-5
mol / L.
2.3.4. Déduire la concentration
molaire C en scopolamine hydrobromide dans le flacon à partir de la
concentration molaire CA.
C = 20 CA = 20 x4,58 × 10-5
=9,2 10-4 mol /L
2.3.5. Vérifier que cette valeur est
proche de celle obtenue en 2.2.
9,2 10-4 mol /L et 9 10-4 mol /L sont des valeurs
proches.
|
|
|
Exercice 2 : La leucine, une solution à
l’atrophie musculaire.
Les astronautes, en état prolongé d’impesanteur, ne sollicitent pas
beaucoup leurs muscles notamment ceux des jambes qui commencent à
s’atrophier. Pour compenser en partie cette atrophie, un astronaute est
obligé de faire des exercices physiques intenses et réguliers. Il doit
aussi compléter son alimentation par un apport de leucine.

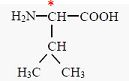
1. Justifier l’appartenance de la
leucine à la famille des acides α-aminés.
La molécule possède une fonction amine et une fonction acide
carboxylique portées par le même carbone.
2. Repérer l’atome
de carbone asymétrique par un astérisque (*) après avoir reproduit la
formule de la leucine sur votre copie.
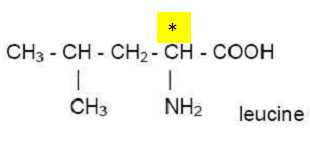
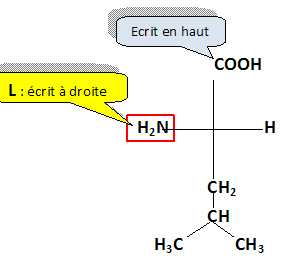
3. Donner la représentation de
Fischer de la leucine de configuration L notée L-Leu.
Dans
l’organisme, la leucine (Leu) fournie par l’alimentation, peut
également s’associer à la valine (Val) afin de former le dipeptide
Leu-Val suivant l’équation :
Leu + Val → Leu-Val + H2O
La formule semi-développée du dipeptide Leu-Val est la suivante :
4. Nommer le
groupe caractéristique entouré dans le dipeptide Leu-Val.
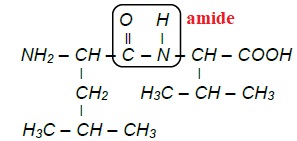
5. Retrouver la
formule semi-développée de la valine à partir de la formule du
dipeptide Leu-Val.
6.
Nommer, en utilisant les abréviations Leu et Val, les trois autres
dipeptides que l’organisme peut former avec ces deux acides α-aminés.
Leu - Leu ; val - val et val-Leu.
|
|
|
|
L’hypergravité provoque
des effets sur l’organisme.
Sur Terre, la taille d’un futur astronaute est de 1,80 m. Lorsqu’il est
debout, son coeur se situe à une hauteur de 1,40 m au-dessus de ses
pieds. La tension artérielle au niveau du coeur est de 13,3 kPa.
1.1. Calculer la
différence de tension artérielle ΔT entre les pieds et le coeur de
l’astronaute sous une gravité « normale ». Exprimer cette valeur en Pa
puis en kPa.
Données : ρsang= 1,06×103 kg·m-3 ; g =
9,81 N·kg-1
1 kPa = 1×103 Pa.
ΔT =ρsang g Dh
=1,06 103 x9,8 x1,40 = 1,45 104 Pa = 14,5 kPa.
1.2. Calculer la
valeur de la tension artérielle au niveau de ses pieds sous une gravité
« normale » à partir du résultat précédent. Reporter cette valeur en
ANNEXE 2.
14,5 -13,3 = 1,2 kPa.
1.3. Choisir et
reporter sur l’ANNEXE 2, la valeur de la tension
artérielle au niveau de la tête, en gravité « normale », parmi les deux
suivantes :
9,1 kPa et 45,5 kPa.
La tension artérielle augmente avec la hauteur, donc 45,5 kPa.
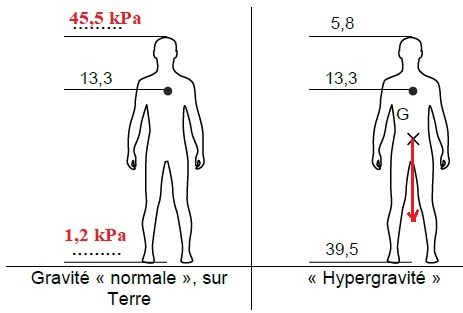
Lors du décollage, l’astronaute est soumis à une phase d’hypergravité
due à l’accélération de la fusée. Il lui est conseillé de rester
allongé durant cette phase.
1.4. En utilisant
l’ANNEXE 2, donner une raison pour laquelle il est déconseillé de
rester debout lors du décollage.
En hypergravité, le sang se dirige vers le bas et le coeur, la tête
sont peu alimentés.
L’astronaute a une masse m égale à 90 kg.
1.5. Calculer le
poids P de l’astronaute sur terre en gravité normale.
P = mg = 90 x9,8 = 882 N ~8,8 102 N.
1.6. Comparer cette
valeur à celle du poids PH en hypergravité.
Données :
L’intensité de la pesanteur en hypergravité gH est égale à 17,6 N·kg-1.
L’intensité de la pesanteur en gravité normale est égale à g = 9,81 N·kg-1
PH = 17,6 x80 ~1,6 103
N soit près du double de sa valeur en gravité normale.
1.7. Donner
les caractéristiques (point d’application, direction, sens, intensité)
de la force poids PH, dont l’intensité est égale à 1.6
kN.
Le poids s'applique au centre de gravité ; sa direction est la
verticale ; son sens : vers le bas.
1.8. Représenter le
vecteur poids correspondant sur le schéma de l’annexe en utilisant
l’échelle proposée 1 cm pour 800 N..
|
|
Effet sur la structure osseuse.
La perte de calcium des os les rend moins absorbants aux rayons X.
Dans l’espace, le corps est en apesanteur. Les os se fragilisent car le
renouvellement des tissus osseux n’est plus réalisé correctement : le
calcium passe dans le sang puis est évacué par l’urine. Ce phénomène
est appelé l’ostéoporose.
Pour remédier à ce problème, une alimentation riche en calcium et une activité sportive régulière sont nécessaires.
On utilise les rayons X pour réaliser la radiographie des jambes d’un
astronaute à son retour sur Terre. On obtient les deux images suivante.
Image extraite de http://www.medisite.fr
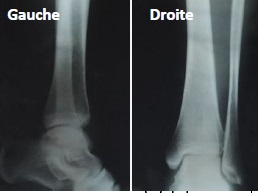
2.1. Identifier la jambe atteinte d’ostéoporose en comparant les deux images. Justifier votre choix.
La jambe atteinte d'ostéoporose absorbe moins les rayons X ; les structures osseuses apparaissent en blancs.
La jambe droite n'est pas atteinte ; la jambe gauche est atteinte d'ostéoporose.
2.2. Citer deux risques encourus suite à une exposition régulière aux rayonnements X.
Cancers, malformations foetales.
2.3. Indiquer un moyen utilisé par les manipulateurs en radiographie pour se protéger des rayons X.
Protection à l'aide d'écrans de plomb.
|
|