Energie thermique
des mers,
bac S Polynésie 2019
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
L’exploitation
de la différence de température entre les eaux de surface et les eaux
profondes des océans et des mers permet de produire de l’énergie. Cette
technologie, appelée Énergie Thermique des Mers (ETM) ou océanothermie
est particulièrement adaptée à la zone intertropicale où la variation de température est importante.
Implanté en Martinique, NEMO (New Energy for Martinique and Overseas)
est un projet de centrale flottante de production d’énergie thermique
de puissance 10,7 MW.
L’objectif de cette étude est de montrer l’intérêt environnemental de
cette nouvelle technologie par rapport aux centrales thermiques à fuel.
Bilan carbone de l’ETM.
L’eau pompée en profondeur lors du fonctionnement de la station ETM a une teneur en dioxyde de carbone dissous égale à 202 x 10-6 mol.L-1, plus élevée que la teneur des eaux de surface.
À la sortie de la station ETM, l’eau pompée en profondeur est rejetée
en surface. Une partie du dioxyde de carbone en excès contenu dans
cette eau est consommée pour produire de la matière vivante. Cette
production biologique se fait grâce à la présence de sels nutritifs
dissous dans l’eau, notamment les ions nitrate NO3- (aq) présents dans l’eau de mer. L’ordre de grandeur de la concentration molaire en ions
nitrate est 10-5 mol.L-1.
L’élaboration de la matière vivante s’opère en utilisant en moyenne 6,8 moles de CO2 pour une mole d’ions nitrate.
L’excès résiduel de dioxyde de carbone est libéré dans l’atmosphère.
D’après CarbonDioxide Information Analysis Center CDIAC
Dosage des ions nitrate présents en eaux profondes.
Un technicien doit déterminer la concentration molaire des ions nitrate NO3- des eaux de mer par spectroscopie.
Pour cela, il prépare 1,00 L de solution mère S en dissolvant 160 mg de nitrate d'ammonium, de formule NH4NO3, dans de l’eau distillée salée comme les eaux profondes.
À partir de cette solution mère, il obtient par dilution quatre solutions de 100 mL, notées S1 à S4.
Il ajoute dix gouttes d'acide 2,4-phénoldisulfonique à chaque solution.
Chacune d’elles prend une coloration jaune d’autant plus intense que la
concentration en ions nitrate est grande.
Il mesure l’absorbance des différentes solutions pour une longueur
d’onde égale à 415 nm. Les résultats des mesures obtenues par le
technicien sont donnés dans le tableau.
Le technicien prélève, au niveau de la sortie de la station ETM, de
l’eau de mer pour laquelle il veut mesurer la concentration en ions
nitrate notée Sconcentrée. Il chauffe l’échantillon pour en
réduire le volume d’un facteur 10. Après avoir ajouté dix gouttes
d'acide 2,4-phénoldisulfonique à 100 mL de cette solution, il mesure
son absorbance : A = 0,37.
Données :
· Masses molaires : M(NH4NO3) = 80,0 g.mol-1 ; M(CO2) = 44,0 g.mol-1.
· Dissolution du nitrate d’ammonium dans l’eau :
NH4NO3(s)---> NH4+(aq) + NO3-(aq)
· Relation entre puissance P (en W) et énergie E (en J) échangée pendant Δt (en s) : E = PΔt
· 1 Wh = 3,6 x 103 J
· Cercle chromatique :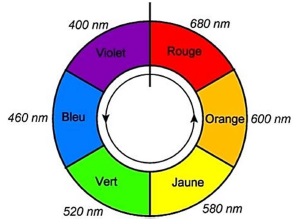
|
|
...
.
|
|
|
1. Détermination de la teneur en ions nitrate des eaux profondes
1.1. Justifier le réglage du spectrophotomètre à 415 nm par le technicien pour ce dosage
.Les solutions étant jaune, elles présentent un maximum d'absorption
dans le violet ( couleur complémentaire du jaune) vers 415 nm.
1.2. Quel est l’intérêt du chauffage de l’échantillon d’eau de mer ?
La concentration initiale de l'eau de mer en ion nitrate est multipliée par 10.
1.3. Calculer la
concentration de la solution-mère et de chacune des solutions filles
dont les caractéristiques sont données dans le tableau récapitulatif
des résultats obtenus par le technicien,
copie. Compléter les deux documents présents.
Solution
|
S1
|
S2
|
S3
|
S4
|
Volume de solution fille ( mL)
|
100
|
Volume de solution mère prélevé ( mL)
|
5,0
|
10
|
20
|
40
|
Concentration de la solution fille (mol / L)
|
2 10-3 x 5 /100
=1,00 10-4
|
2 10-3 x 10 /100
=2,00 10-4 |
2 10-3 x 20 /100
=4,00 10-4 |
2 10-3 x 40 /100
=8,00 10-4 |
Absorbance
|
0,14
|
0,28
|
0,55
|
1,1
|
Quantité de matière de nitrate d'ammonium dns 1 L de solution mère :
n = 0,160 / 80,0 = 2,00 10-3 mol dans 1 L.
Expliciter la méthode de détermination par le technicien de la
concentration molaire en ions nitrate des eaux profondes pompées par la
future station NEMO et vérifier que l’ordre de grandeur de la
concentration en ions nitrate donnée dans le sujet est correct.
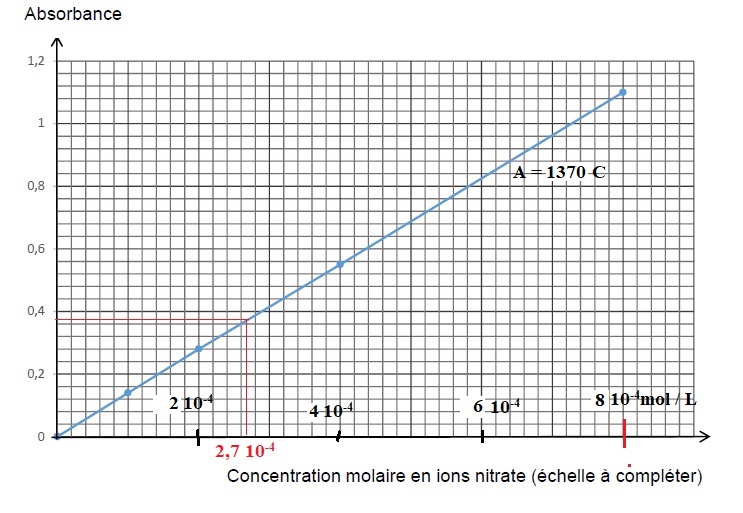
Tenir compte du facteur de réduction de 10. La concentration en ion nitrate des eaux profondes est voisine de 2,7 10-5 mol/ L. En accord avec " l’ordre de grandeur de la concentration molaire en ions
nitrate est 10-5 mol.L-1".
|
|
|
|
2. Intérêt environnemental de NEMO.
En Martinique, l’énergie électrique est essentiellement produite par
des centrales au fuel qui rejettent 890 g de dioxyde de carbone CO2 par kWh d’énergie électrique produite.
Quelle masse de CO2 le projet NEMO permettra-t-il d’éviter
de rejeter par an si on le met en oeuvre en remplacement d’une centrale
thermique au fuel de même puissance que NEMO ? Commenter le résultat
obtenu.
Débit volumique de la pompe de la station ETM : D = 33 m3.s-1.
Masse de dioxyde de carbone rejetée par une centrale au fuel de puissance 10,7 MW par une heure de fonctionnement :
10,7 MWh =1,07 104 kWh.
0,890 x 1,07 104 = 9,52 103 kg ~ 9,5 tonnes.
Teneur en dioxyde de carbone dissous des eaux profondes : 202 x 10-6 mol.L-1.
L’ordre de grandeur de la concentration molaire en ions nitrate est 10-5 mol.L-1.
Volume d'eau rejetée en une heure : 33 x 3600 =1,188 105 m3 = 1,188 108 litres.
Quantité de matière d'ion nitrate contenu dans ce volume : 1,188 108 x 10-5 ~1,2 103 mol.
L’élaboration de la matière vivante s’opère en utilisant en moyenne 6,8 moles de CO2 pour une mole d’ions nitrate.
Quantité de matière de CO2 correspondante : 6,8 x1,188 103 ~8,1 103 mol.
Quantité de matière de CO2 dans 1,188 108 litres d'eaux profondes : 202 10-6 x1,188 108 ~2,4 104 mol.
Quantité de matière de CO2 rejeté dans l'atmosphère : 2,4 104 -8,1 103 = 1,6 104 mol.
Masse correspondante : 1,6 104 x0,044 =7,0 102 kg.
Rejet de CO2 évité en une heure : 9,5 103 -7 102 =8,8 103 kg = 8,8 tonnes.
Soit par an : 8,8 x 24 x 365 ~7,7 104 tonnes.
Cette nouvelle technologie présente un intérêt environnemental important par rapport aux centrales thermiques à fuel.
|
|
|
|