Dioxyde
de carbone dans l'atmosphère, bac S Nlle Calédonie 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
| .
. |
......
.....
|
Le taux moyen de dioxyde de carbone dans l'atmosphère en l'an 2000 était d'environ 370 ppm.
Le but de cet exercice est de déterminer, un après midi d'automne 2018, le taux de CO2 contenu dans l'air extérieur d'une ville de la région parisienne.
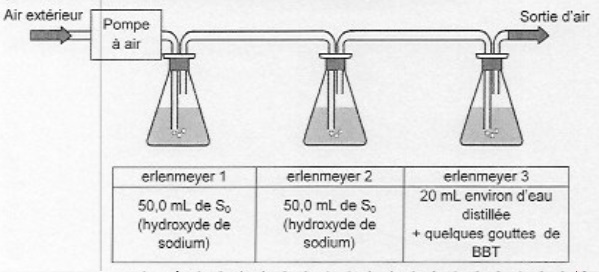
Le montage suivant permet d'envoyer de l'air atmosphérique dans une solution commerciale S0
d'hydroxyde de sodium. Le dioxyde de carbone se dissout dans la
solution et réagit avec les ions hydroxyde dans les erlenmeyers 1 et 2.
L'eau du troisième erlenmeyer contenant du bleu de bromothymol ne
change pas de couleur, ce qui permet de vérifier que la totalité du CO2 introduit a été dissout dans les erlenmeyer 1 et 2.
Pour déterminer la quantité initiale d'ion hydroxyde dans la solution S0,
on prélève un volume de 100 mL de cette solution et on réalise un
titrage par une solution d'acide chlorhydrique de concentration C
=0,100 mol/L.
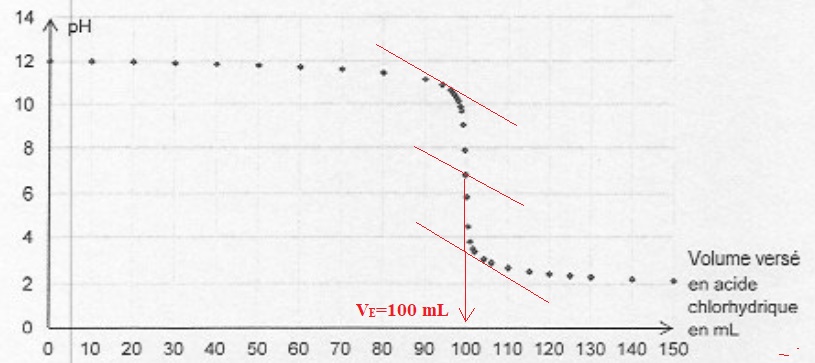
Après
1h 30 min de fonctionnement de la pompe à air, les contenus des
erlenmeyers 1 et 2 sont rassemblés. On obtient la solution S1. Un test au papier pH permet d'estimer que la valeur du pH est d'environ 12.
Un titrage permet de déterminer la quantité d'ion hydroxyde restant dans la solution S1. On trouve n(HO-) = 7,2 mmol.
1. Calculer la quantité de matière en ion hydroxyde dans 100 mL de S0.
CVE = 0,1 x100 = 10 mmol.
2. Parmi les espèces chimiques suivantes CO2,H2O ; HCO3-, CO32- déterminer la forme prédominante dans la solution S1.
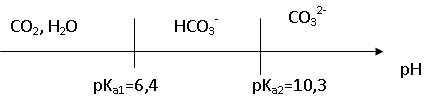 A pH ~12, l'ion CO32- prédomine.
A pH ~12, l'ion CO32- prédomine.
3. En déduire l'équation de réaction ayant lieu dans les erlenmeyers 1 et 2 lors du barbotage de l'air atmosphérique.
CO2, H2O aq + 2HO- aq---> CO32-aq + 2H2O(l).
|
|
.
|
....
|
Problème.
Déterminer le taux de dioxyde de carbone de l'air atmosphérique au moment de l'expérience. Commenter le résultat obtenu.
Débit de la pompe : 51 ± 2 litres par heure soit V = 51 x1,5 = 76,5 L d'air.
V est compris entre 73,5L et 79,5 L.
Quantité de matière d'ion hydroxyde ayant réagi avec le dioxyde de carbone :
10-7,2 = 2,8 mmol.
Quantité de matière de dioxyde de carbone correspondante : 2,8 / 2 = 1,4 mmol.
Volume de dioxyde de carbone sachant qu'une mole de gaz occupe un volume de 23 L dans les conditions de l'expérience:
1,4 10-3 x23 ~0,032 L de CO2 dans un volume V d'air.
1 ppm correspond à un litre de CO2 dans 106 litres d'air.
Le taux de CO2 est compris entre : 0,032 x 106 / 73,5 ~435 ppm.
0,032 x 106 / 79,5 ~403 ppm.
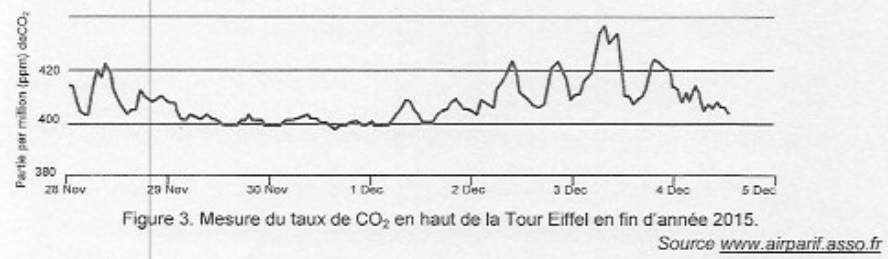
La valeur trouvée est en accord avec les relevés.
Elle est également en accord avec l'évolution de la concentration en CO2 de l'atmosphère au niveau mondial.
|
|



