L'acide
pantophénique, bac S Amérique du sud 2019.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
| .
. |
......
.....
|
La vitamine B5, ou acide
pantothénique, est indispensable au métabolisme des différents nutriments énergétiques : glucides, lipides et acides aminés.
Par ailleurs, elle participe à la synthèse de certaines hormones
(cortisol, aldostérone, adrénaline), est essentielle à la croissance des tissus (cicatrisation
de la peau, pousse des cheveux) et est utile au bon fonctionnement intellectuel.
Formule de l’acide pantothénique :
Cet exercice a pour but d’étudier quelques caractéristiques de la
molécule d’acide pantothénique, d’étudier une synthèse de cet acide et d’analyser un
complément alimentaire permettant son apport.
1. La molécule d’acide pantothénique.
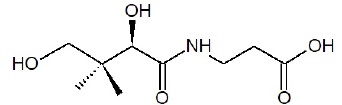
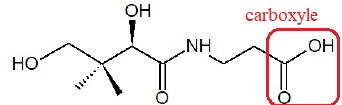
1.1. Sur la formule semi-développée de la molécule, entourer le groupe caractéristique justifiant le
qualificatif d’acide associé à son nom.
 1.2. Expliquer pourquoi cette espèce chimique est qualifiée de «
polyfonctionnelle ».
1.2. Expliquer pourquoi cette espèce chimique est qualifiée de «
polyfonctionnelle ».
La molécule possède une fonction amide, deux fonctions alcool et une fonction acide carboxylique.
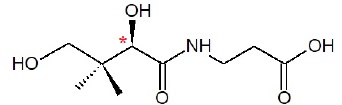
1.3. La molécule d’acide pantothénique possède-t-elle un ou plusieurs
atome(s) de carbone asymétrique(s) ?
Sur la formule donnée, repérer cet
(ces) atome(s) avec un astérisque (*). Justifier.
Cette molécule possède un atome de carbone asymétrique, carbone tétraèdrique lié à 4 atomes ou groupes d'atomes différents.
1.4. Déterminer parmi A et B lequel est un énantiomère de l’acide
pantothénique. Justifier.
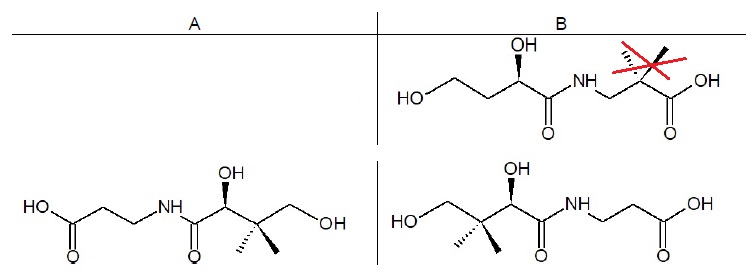
A et l'acide pantophénique sont images l'un de l'autre dans un miroir plan.
Le spectre RMN de l’acide pantothénique comporte, entre autres, deux
signaux triplets.
On rappelle que les protons portés par un atome d’azote ou d’oxygène ne
donnent pas de couplage avec les protons voisins.
1.5. Identifier le ou les groupes de protons responsables de ces triplets.Justifier.
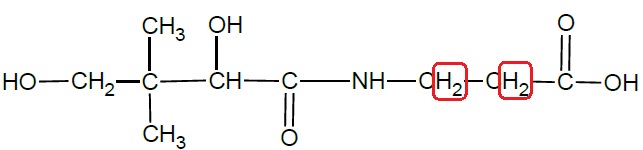
L'atome de carbone le plus proche compte deux protons. Donc un triplet pour chaque CH2.
1.6. Expliquer pourquoi un seul signal correspond aux groupes de protons encadrés dans la formule ci-après.
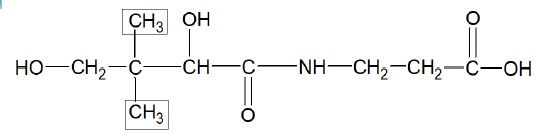
Ces protons ayant le même environnement, sont équivalents. L'atome de
carbone le plus proche ne possèdant pas d'hydrogène, le signal de ces
six protons sera un singulet.
|
|
.
|
....
|
2. Synthèse de l’acide pantothénique.
Données
- Couples acidobasiques et pKA de la β-alanine : C3H8NO2+ / C3H7NO2 (pKA1 = 2,3) ; C3H7NO2 / C3H6NO2- (pKA2 = 9,7)
- Valeurs d’électronégativité de quelques atomes : χC = 2,55; χO = 3,44 ; χN = 3,04; χH = 2,20.
L’acide pantothénique peut être obtenu à partir de l’acide pantoïque et
de la β-alanine selon la réaction de synthèse d’équation suivante :
2.1. Sur l’équation de réaction, entourer, pour chaque réactif, le groupe caractéristique qui réagit.
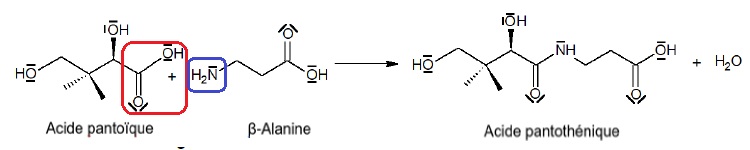
2.2. À quel problème peut-on être confronté si l’on souhaite obtenir uniquement l’acide pantothénique ?
Une fonction alcool de l'acide pantoïque peut réagir avec la fonction carboxylique de la ß-Alanine.
Première étape de la synthèse.
Pour favoriser la formation du produit désiré, on fait réagir, dans une
première étape, l’acide pantoïque avec l’ion carboxylate de la
β-alanine selon la réaction d’équation-bilan suivante :
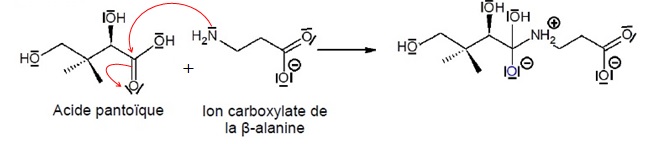
2.3. Donner, en justifiant, le nom de la catégorie de réaction correspondant à cette étape.
Addition sur la double liaison C=O.
2.4. Compléter le mécanisme en indiquant les flèches courbes.
2.5. Compléter le
diagramme de prédominance des différentes formes de la β-alanine avec
les formules chimiques et les valeurs numériques manquantes.
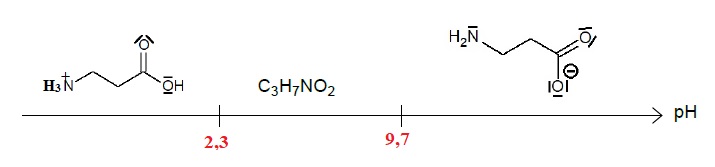
2.6. Dans quel domaine de pH doit-on se situer pour obtenir l’ion carboxylate de la β-alanine ?
pH supérieur à 9,7.
|
Dernière étape de la synthèse.
Le produit issu de la première étape conduit finalement à la formation
de l’ion pantothénate , que nous noterons pour simplifier RCOO –.
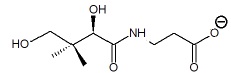
Une fois la réaction de synthèse terminée, on ajoute de l’acide chlorhydrique (H3O+(𝑎𝑞)+ Cl –(𝑎𝑞)) pour obtenir l’acide pantothénique.
2.7. Donner l’équation de la réaction observée lors de l’ajout d’acide chlorhydrique et indiquer la nature de cette réaction.
Réaction acide base : RCOO- aq + H3O+ aq---> RCOOH aq + H2O(l).
3. Apports d’acide pantothénique par un complément alimentaire
L’apport en vitamine B5 est assuré par l’alimentation. Néanmoins, il est possible de le compléter à l’aide de
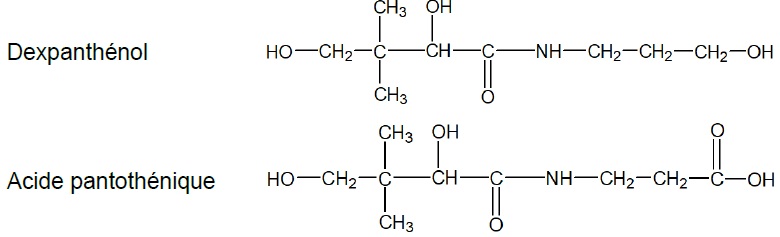
comprimés de Bépanthène, contenant un dérivé de l’acide pantothénique :
le dexpanthénol. Une fois ingéré, le dexpanthénol est transformé
rapidement en acide
pantothénique, qui peut être assimilé par le corps.
La masse indiquée sur la boite ( 100 mg ) correspond à la masse de dexpanthénol contenu dans un comprimé.
L’acide pantothénique étant hydrosoluble, tout excès dans l’organisme
est facilement évacué. Il n’a pas été décrit d’effet secondaire suite à
l’ingestion d’acide pantothénique.
Données
Masse molaire moléculaire : Dexpanthénol M = 205,0 g.mol-1.
Apports suffisants en vitamine B5 (acide)
de 0 à 12 mois 1,7 mg ; de 1 an à 8 ans 2,0 mg ; de 9 ans à 13 ans 4,0 mg ; 14 ans et plus 5,0 mg ; Femmes enceintes 6,0 mg
En l'absence de données scientifiques suffisantes, les autorités ont
fixé, non pas un apport nutritionnel recommandé (ANR), mais un apport
suffisant (AS),
L'apport suffisant est un apport quotidien moyen recommandé.
Source : Institute of Medicine, Food and Nutrition Board, 2000.
Formules semi-développées du dexpanthénol et de l’acide pantothénique.
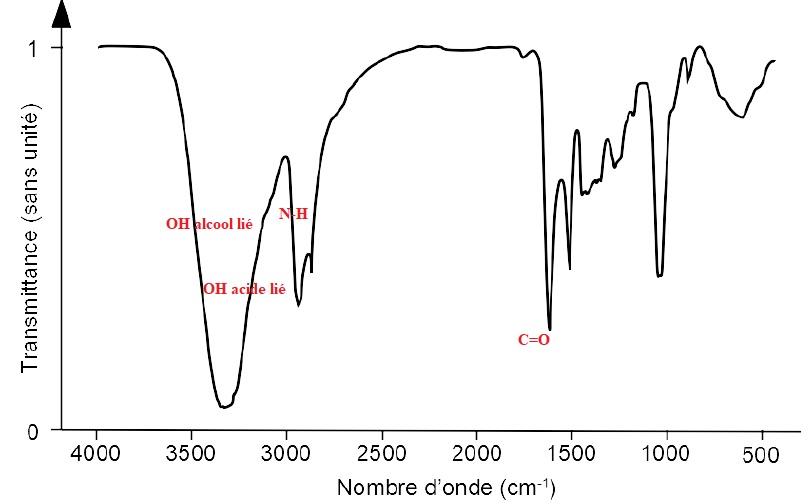
3.1. Le spectre IR ci-dessous peut-il être celui de l’acide pantothénique ? Oui.
3.2. Écrire la formule brute de la molécule d’acide pantothénique.
C9H17O5N.
On suppose que, une fois le comprimé ingéré, chaque molécule de
dexpanthénol se transforme en une molécule d’acide pantothénique.
3.3. Un comprimé de
Bépanthène est-il suffisant pour couvrir les apports en vitamine B5
d’une femme enceinte ? Si cette ingestion correspondait à un surdosage
présenterait-elle
un danger ?
Quantité de matière de dexpanthénol dans un comprimé : n = 0,100 / 205 ~4,9 10-4 mol.
M(C9H17O5N) =9 x12 +17 +5 x16 +14 =219 g / mol.
Quantité de matière d’acide pantothénique dans un comprimé : 4,9 10-4 mol.
Masse correspondante : 4,9 10-4.x219 ~0,107 g ou 107 mg.
Cette valeur étant supérieure à 6,0 mg, l'apport est largement suffisant.
Ce surdosage ne
présente pas un danger car l’acide pantothénique étant hydrosoluble,
tout excès dans l’organisme est facilement évacué.
|
|
|











