Structure
électronique et liaisons chimiques, Médecine Paces.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
Exercice
1. L'atome de brome.
Q1. La configuration électronique du 8035Br dans son état fondamental est :
A. 1s2 2s2 2p6 3s2 3p6 3d8 4s2 4p6.
B. 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p5. Vrai.
C. 1s2 2s2 2p6 3s2 3p6 3d10 4s1 4p5.
D. 1s2 2s2 2p6 3s2 3p5 3d10 4s2 4p6.
E. 1s2 2s2 2p6 3s2 3p6 3d8 4s2 4p5.
Q2. La ( ou les) forme(s) du 8035Br est (sont) donc :
A. Le cation Br+.
B. Le dibrome Br2. Vrai.
C. Le brome seul Br
D. L'anion Br-. Vrai.
E. L'ion Br2+.
Q3. La composition du noyau 8035Br est :
A. 80 nucléons. Vrai.
B. 35 neutrons / 35 protons.
C. 45 neutrons / 35 protons. Vrai. ( 80-35 = 45 neutrons)
D. 35 protons / 35 électrons.
E. 35 neutrons / 45 protons.
Q4. Le rayon atomique du 8035Br est :
A. Plus petit que celui de l'hélium.
B. Plus petit que celui du potassium. Vrai.
C. Plus grand que celui de l'oxygène. Vrai.
D. Plus grand que celui du fer.
E. Plus petit que celui du carbone.
Le rayon atomique diminue en traversant une période de gauche à droite et augmente en descendant un groupe.
Br ( 115 pm) ; K(220 pm) ; O(90 pm) ; Fe(140 pm) ; C (85 pm).
Exercice 2 : les nombres quantiques.
Q5. Quelle(s) est ( sont) la ( les ) proposition(s) exacte(s) ?
A. l est le nombre quantique magnétique. Faux. ( nombre quantique azimutal)
B. Les valeurs de l sont comprises entre n-1 et n+1. Faux. ( entre 0 et n-1 ).
C. La combinaison n = 3 et l = 2 définit des orbitales 3p. Faux. ( l = 1 pour les orbitales p).
D. La combinaison n = 2 et l = 1 définit des orbitales 2p. Vrai.
E. Les nombres quantiques l et m définissent les sous-couches.. Faux.
l définit les sous -couches et m le nombre d'orbitales par sous couche.
Q6.Combien d'électrons au maximum peut contenir la couche n = 4 ?
A. 8 :
B. 18 ; C. 24 ;
D. 32. Vrai ;
E. 60.
2n2 = 2 x42 = 32.
Q7. Quelle(s) est ( sont) la ( les ) proposition(s) exacte(s) ?
A. Une liaison covalente résulte du recouvrement de 2 orbitales atomiques. Vrai.
B. Une liaison s est plus forte qu'une liaison p. Vrai.
C. Une triple liaison entre deux atomes de carbone est constituée de 2 liaisons s et une liaison p. Faux. (1 liaison s et 2 liaison p ).
D. Une liaison p résulte du recouvrement axial d'orbitales atomiques. Faux. ( recouvrement latéral)
E. Une liaison s peut être délocalisée sur plusieurs atomes.. Faux.
|
|
|
|
|
Exercice 3 : VSEPR.
Conaissnt les numéros atomiques du carbone (6), de l'azote (7), de
l'oxygène (8) et du fluor (9) donner la représentation de Lewis et de
Gillespie des molécules CF4, H2O, HCN, CH3-, CO32-, NO2-.
CF4 : l'atome central est le carbone ( 4 électrons de valence) ; forme tétraèdrique type AX4.
H2O
: l'atome central est le l'oxygène ( 6 électrons de valence) ; 2
électrons engagés dans deux liaisons simples et deux doublets non
liants : forme en V type AX2E2.
HCN : l'atome central est le carbone ( 4 électrons de valence) ; 1 électron
engagé dans 1 liaison simple avec H et 3 électrons engagés dans une
liaison triple avec N ; forme linéaire type AX2.
CH3- : l'atome central est le carbone ( 4 électrons de valence) ; 3 électrons
engagés dans 3 liaisons simples avec H et un doblet d'électrons libre : forme pyramidale à base triangulaire, type AX3E.
CO32-:
l'atome central est le carbone ( 4 électrons de valence ) ; trois
liaisons avec trois oxygène et aucun doublet non liant ; forme
triangulaire plane, type AX3.
NO2-. l'atome central est l'azote ( 5
électrons de valence ) ; 3 électrons engagés avec 2 atomes d'oxygène et
un doblet non liant sur l'azote ; forme triangulaire, type AX2E.
Exercice 4.
1. Indiquer, parmi les
configurations électroniques suivantes, cell(s) qui représente(nt)
l'état fondamental, un état excité ou une configuration interdite de
l'élément azote ( Z = 7).
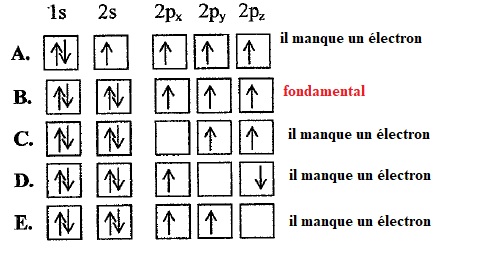
2. Indiquer,
parmi les configurations électroniques suivantes, cell(s) qui
représente(nt) l'état fondamental, un état excité ou une configuration
interdite de l'élément fer ( Z = 26).
A. 1s2 2s2 2p6 3s2 3p6 3d6 4s0 .( il manque deux électrons).
B. 1s2 2s2 2p6 3s2 3p8 3d4 4s2 .( 3p8 est impossible)
C. 1s2 2s2 2p6 3s2 3p6 3d4 4s2 .( il manque deux électrons).
D. 1s2 2s2 2p6 3s2 3p5 3d5 4s2.( il manque deux électrons).
E. 1s2 2s2 2p6 3s2 3p6 3d0 4s2 4p4. Faux. (dans l'état fondamental : 1s2 2s2 2p6 3s2 3p6 3d6 4s2).
Exercice 5 :
Q8. Quelle(s) est ( sont) la ( les ) proposition(s) exacte(s) ?
A. Tous les isotopes ont le même nombre de neutrons. Faux ( des isotopes ont le même numéro atomique Z et des nombres de neutrons différents ).
B. Pour déterminer la configuration électronique d'un atome, on utilise les règles de Hund, Pauli, Lewis et Klechkowsky. Faux. ( règles de Hund et Klechkowsky. )
C. Un électron peut avoir ses 4 nombres quantiques selon la relation n = l-1 = m = s. Faux. ( s, l et m sont entiers et s = ±½ ).
D. L'ion Fe3+ a pour configuration électronique 1s2 2s2 2p6 3s2 3p6 3d5 4s0: Vrai.
E.
La présence de doublets non liants dans la molécule d'eau entraîne un
angle inférieur à 109,5° sur sa forme géométrique suivant le modèle
VSEPR. Vrai.
|
|
Q9. Quelle(s) est ( sont) la ( les ) proposition(s) exacte(s) concernant l'ion PO43- ?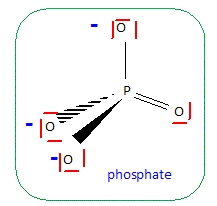 A. Suivant le modèle de Lewis, une charge positive est centrée sur le phosphore. Faux.
A. Suivant le modèle de Lewis, une charge positive est centrée sur le phosphore. Faux.
B. Elle peut être représentée avec trois liaisons simples et ne liaison double. Vrai.
C. Sa géométrie suivant le modèle VSEPR est un arrangement pentagonal. Faux ( tétraèdre).
D. Les longueurs des liaisons phosphore oxygène ne sont pas toutes égales. Faux.
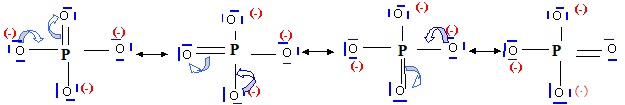
4 formes mésomères limites, 4 liaisons équivalentes
E.
Les angles O-P-O sont tous égaux à 109,5°. Vrai.
Exercice 6: hybridation des orbitales atomiques..
Q 10. Quelle(s) est ( sont) la ( les ) proposition(s) exacte(s) ?
A. Dans CH2=C=O, le carbone en gras est dans l'état d'hybridation sp2. Faux. ( ce carbone est lié à 2 autres atomes, donc sp)
B. Dans CH2=C=CH2, le carbone en gras est dans une configuration tétraèdrique. Faux. ( ce carbone est lié à 3 autres atomes, donc sp2 triangilaire)
C. Dans CH2=C=CH2, tous les carbones sont alignés. Vrai.
D. Dans CH3 -CO-CH2-NH2 l'azote est est dans l'état d'hybridation sp3. . Vrai. (l'azote est lié à 3 autres atomes, et l'azote possède un doblet non liant )
E. Dans CH3 -CO-CH2-NH2 l'azote est est dans l'état d'hybridation sp2. Faux.
Q 11. Quelle(s) est ( sont) la ( les ) proposition(s) exacte(s) ?
A. L'hybridation sp du carbone correspond à une seule paire d'électrons non liant. Faux.
B. Dans son état fondamental, le carbone possède 4 électrons appartenant à des orbitales p. Faux ( 2s2 2p2)
C. L'angle de 109,5° est caractéristique de l'hybridation sp3 du carbone. Vrai.
D. Dans l'hybridation sp2 du carbone, le nombre d'orbitale s est égal à 3 .Vrai. (3 orbitales s et une orbitale p )
E. Dans une liaison p la probabilité de trouver un électron sur la ligne séparant les deux centres et très grande. Faux. ( le recouvrement des orbitales est latéral dans une liaison p et non pas axial ).
Exercice 7. Tableau périodique.
Q 12. Quelle(s) est ( sont) la ( les ) proposition(s) exacte(s) ?
A. Les halogènes sont susceptibles de perdre un électron. Faux.
Les halogènes sont susceptibles de gagner un électron
B. Les halogènes se situent sur la dernière colonne du tableau périodique. Faux ( avant dernière colonne )
C. Les métaux de transition appartiennent au bloc P. Faux ( Bloc P : du groupe 13 au groupe 18 du tableau périodique
D. L'électronégativité augmete de la gauche vers la droite sur une même ligne .Vrai.
E. Le rayon atomique augmente du haut vers le bas d'une même colonne. Vrai.
Exercice 8. Effet inductif.
Classer par ordre d'acidité décroissante les acides carboxyliques
suivants. PKa à attribuer 0,3 ; 1,68 ; 2,66 ; 2,86 ; 3,12 ; 4,76.
CF3-COOH ( 0,3) ; NO2CH2-COOH (1,68) , FCH2-COOH (2,66) ; ClCH2-COOH (2,86) ; ICH2-COOH (3,12) ; CH3-COOH ( 4,76).
Effet inducteur attracteur : CF3 > NO2 > FCH2 > ClCH2 > ICH2 ; effet inducteur donneur CH3.
Plus la densité électronique sur l'oxygène de la base conjuguée est forte, plus l'acide sera faible.
Plus l'effet inducteur attracteur est fort, plus le proton du groupe COOH est mobile, plus l'acide est fort.
Exercice 9. Effet mésomère
Ecrire les formules mésomères limites pour les molécules suivantes :
5-chloropenta-2, 4-diènal et la paranitroaniline. Préciser les formes
les plus stables.
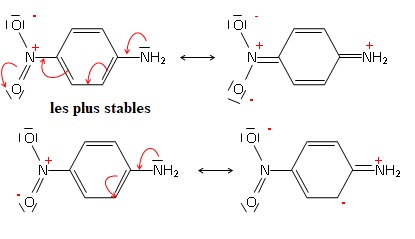
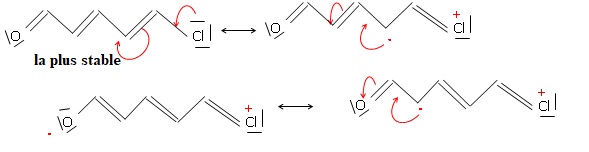
Les formes sont d'autant plus stables qu'elle portent le moins de charges électriques.
Les formes sont d'autant plus stables que les charges électriques sont portées par des atomes électronégatifs.
Exercice 10. Classer par acidité décroissante.
Phénol ; cyclohexanol ; p-nitrophénol ; m-nitrophénol ; 2,4 dinitrophénol.
pKa à attribuer :3,96 ; 7,15 ; 8,4 ; 9,89 ; 15.
2,4 dinitrophénol. ( 3,96) ; p-nitrophénol ( 7,16) ;m-nitrophénol ( 8,4) ; phénol ( 9,89) ; cyclohexanol ( 15).
La base conjuguée est d'autant plus forte lorsque que l'oxygène du groupe OH porte une charge négative importante.
Le groupe nitro est attracteur.
Plus la base conjuguée est forte, plus l'acide est faible.
Exercice 11. Classer par ordre de basicité décroissante.
pKa à attribuer :4,6 ; 9,3 ; 10,7 ; 11.
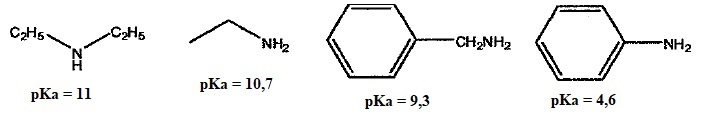
La base est d'autant plus forte que l'azote porte une charge négative importante.
Les groupes C2H5 sont donneurs par effet inducteur.
Dans l'aniline, le doublet de l'azote est peu disponible, étant délocalisé sur le cycle.
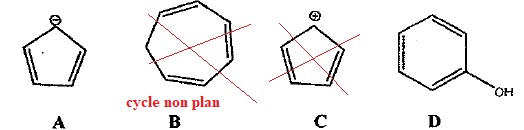
Exercice 12. Indiquer parmi les composés suivants ceux qui présentent un caractère aromatique.
Règle de Hückel. un hydrocarbure est aromatique s'il est plan et possède 4 n+2 électrons délocalisés.
Exercice 13. Classer par ordre de stabilité croissante les carbocations et carbanions suivants.
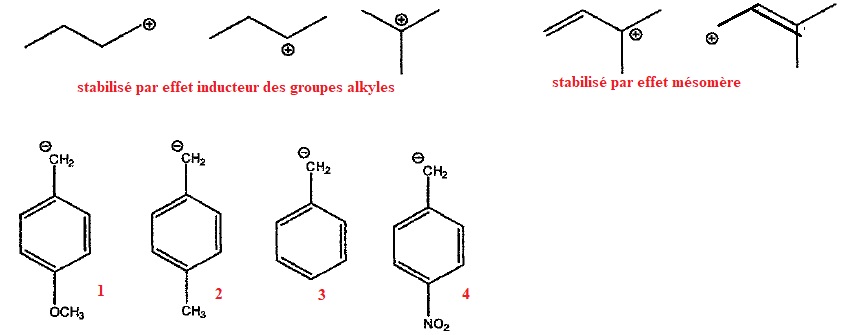
Les carbanions dont la charge peut être délocalisée sont les plus stables.
1 et 2 : présence de groupes donneurs sur le cycle.
4 présence d'un groupe attracteur sur le cycle.
|
|