Chimie,
concours externe TSPEI 2016.
Technicien Supérieur Principal de l'Economie et de l'Industrie
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
Structure de quelques gaz.
1. Donner les structures électroniques des éléments H, C, O, N et S.
H : 1 s1 ; C : 1s2 2s2 2p2 ( 4 électrons externes)
O : 1s2 2s2 2p4 ( 6 électrons externes)
N : 1s2 2s2 2p5 ( 7 électrons externes)
S : 1s2 2s2 2p6 3s2 3p4 ( 6 électrons externes)
2. Représenter les structures de Lewis des molécules suivantes : CO2, SO2, CH4, NO.
3. Indiquer la géométrie des molécules CO2, SO2 et CH4.
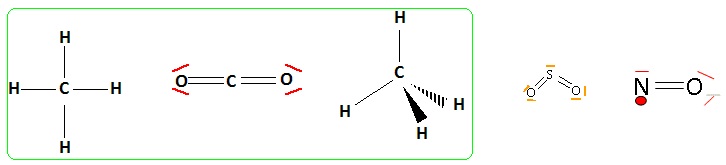
CH4 : type AX4, tétraèdrique.
CO2 : type AX2, linéaire.
SO2 : type AX2E, coudée.
4 Parmi les trois molécules CH4, SO2, CO2 indiquer celles qui sont polaires. Justifier.
CH4 et CO2 ne sont pas polaires : du fait des
symétries, la barycentre des charges positives coincide avec le
barycentre des charges négatives.
SO2 est polaire. Le barycentre des charges positives est sur
le soufre et le barycentre des charges négatives est entre les atomes
d'oxygène.
Extraction du fer.
La décomposition de la sidérite FeCO3 joue un rôle important dans l'extraction du fer.
FeCO3(s) = FeO(s) + CO2(g).
1.a Déterminer l'enthalpie standard de réaction et commenter son signe.
DrH° =DrH°(CO2(g))+DrH°(FeO(s))-DrH°(FeCO3(s)).
DrH° = -393 -260 +740 = 87 kJ /mol.
DrH° >0, réaction endothermique.
1.b. Quelle est l'influence de la température sur cet équilibre ? Justifier.
A pression constante, une élévation de température déplace l'équilibre dans le sens direct, la réaction étant endothermique.
2. Déterminer l'entropie de la réaction et commenter son signe.
DrS° =S°(CO2(g))+S°(FeO(s))-S°(FeCO3(s)).
DrS° = 214 +58 -93 = 179 J /mol.
DrS° >0, le désordre augmente, l'un des produits étant un gaz.
3.a Déterminer la valeur de la constante d'équilibre thermodynamique K à T =500 K.
Les grandeurs ci-dessus sont supposées indépendantes de la température.
DrG° =DrH° -T DrS° =8,7 104 -500 x179 = -2500 J / mol.
DrG° = -RT ln K ; ln K = 2500 / (8,314 x500) =0,601 ; K ~ 1,8.
3.b. En déduire la pression de dioxyde de carbone à l'équilibre
K = PCO2 = 1,8 bar..
|
|
|
|
Dépôt de nickel métallique.
On plonge une lame de fer dans une solution de sulfate de nickel.
E°(Ni2+ /Ni) = -0,23 V ; E°(Fe2+ /Ni) = -0,44 V.
1. Ecrire l'équation de la réaction entre les ions nickel(II) et le fer. Cette réaction est-elle spontanée ? Justifier.
Le fer est un réducteur plus fort que le nickel. La réaction est spontanée.
Ni2+aq + Fe(s) =Fe2+aq + Ni(s).
2.
La vitesse de la réaction s'annule quand le dépôt de nickel atteint une
épaisseur de l'ordre de quelques dizaines de nanomètres. Proposer une
explication.
Le dépôt compact de nickel supprime le contact entre les réactifs. Il n'y a plus de réaction.
Le dépôt électrochimique de nickel est utilisé
industriellement. La pièce de fer à revétir est immergée dans une
solution de sulfate de nickel, puis on effectue une électrolyse. La
pièce de fer sert de cathode et l'anode est inerte. L'épaisseur de
nickel déposé n'est pas limitée. Elle est fonction de la densité de
courant, de la durée de l'opération et de l'intervention éventuelle de
réactions cathodiques parasites.
Pièce traitée : disque de fer, diamètre d = 10 cm, l'épaisseur est
négligée dans le calcul de l'aire totale ; dépôt sur les deux faces.
Masse initiale mi = 30,866 g.
Intensité du courant I = 2,4 A. Durée de l'électrolyse Dt = 65 min.
Masse finale mf=32,051 g.
2. Quelle est la quantité d'électricité Q mise en jeu ?
Q = I Dt = 2,4 x65 x60 =9360 C.
3. Quelle masse m de nickel aurait-on pu obtenir avec un rendement de 100 % ?
Quantité de matière d'électrons : n(e-) = Q / 98500 = 9360 / 96500 =0,097 mol
Ni2+aq + 2e- ---> Ni(s).
Quantité de matière de nickel : 0,5 n(e-) =0,0485 mol.
M(Ni) = 58,71 g/mol. Masse de nickel : 0,0485 x58,71 ~2,847g ~2,85 g.
4. Déterminer le rendement de l'électrolyse.
Masse réelle de nickel déposé : 32,051 -30,866 =1,185 g.
Rendement : 1,185 / 2,847 = 0,416 ( ~42 %).
5. Quelle est l'épaisseur e du dépôt obtenu ? rNi = 8,90 103 kg m-3.
Volume de nickel = masse / masse volumique = 1,185 10-3 / (8,90 103) =1,33 10-7 m3 = 0,133 cm3.
Aire des deux faces du disque : 2 x3,14 x52 =157,08 cm2.
e = 0,133 / 157,08 ~8,5 10-4 cm ou 8,5 µm.
|
|
|
|
|
Titrage de l'acide phosphorique.
Réaction de la synthèse :Ca3(PO4)2 + 3H2SO4 +6H2O---> 3(Ca SO4,2H2O) + 2H3PO4.
Le rendement est déterminé en titrant la quantité d'acide phosphorique formé et celle d'acide sulfurique restant.
1. Définir un acide selon Brönsted. Quest ce qu'un acide fort ? Un acide faible ?
Un acide est une espèce susceptible de céder u proton H+. Un acide fort est entierement ionisé dans l'eau. La réaction d'un acide faible avec l'eau est partielle.
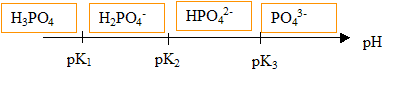
2. Tracer le diagramme de prédominance des espèces acido-basiques de l'acide phophorique.
Données (à 25 °C) : pK1 (H3PO4
/ H2PO4-) = 2,1 ; pK2 (H2PO4-
/ HPO42-) = 7,2 ; pK3 (HPO42-
/ PO43- ) = 12,4 .
Titrage d'une solution d'acide sulfurique.
On titre Va = 10,0 mL d'une solution d'acide sulfurique ( 2H3O+, SO42-) de concentration Ca = 0,100 mol/L par une solution d'hydroxyde de sodium de concentration Cb = 0,100 mol/L. On suit le titrage par pHmétrie.
3.a Ecrire l'équation de la réaction de titrage.
H3O+ aq +HO-aq ---> 2H2O(l).
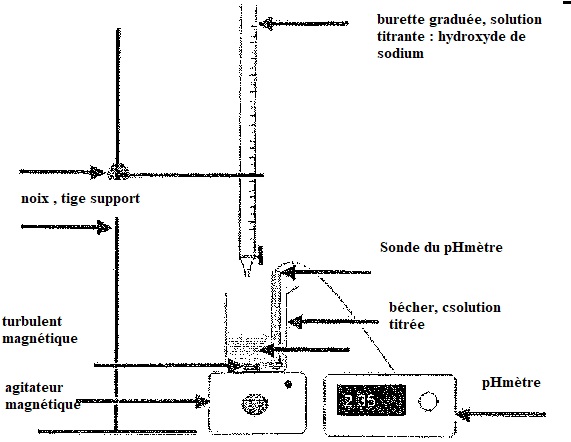
3.b Annoter le schéma du dispositif de titrage
3.c. Donner l'allure de la courbe de titrage pH = f(Vb).
Un seul saut de pH est observé car les deux acidités de l'acide sulfurique sont de force voisine.
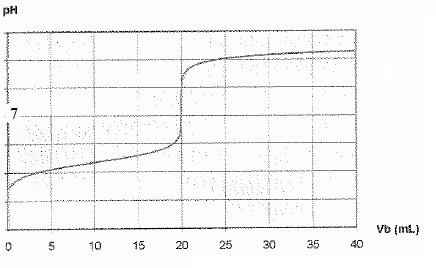
3.d. Calculer la valeur de Vb à l'équivalence. L'acide sulfurique est un diacide fort.
H2SO4 + 2 NaOH ---> Na2SO4 + 2H2O.
A l'équivalence : n(soude) =2 n(acide sulfurique).
Cb Vb = 2 CaVa ; Vb=2 x0,100 x10,0 /0,100 =20,0 mL.
|
|
On titre Va = 10,0 mL d'une solution d'acide phosphorique de concentration C'a = 0,150 mol/L par une solution d'hydroxyde de sodium de concentration Cb = 0,100 mol/L
On donne la courbe pH = f(Vb) ainsi que les courbes de disrtibution des espèces..
4a. Attribuer chaque courbe de distribution à chaque espèce acido-basique
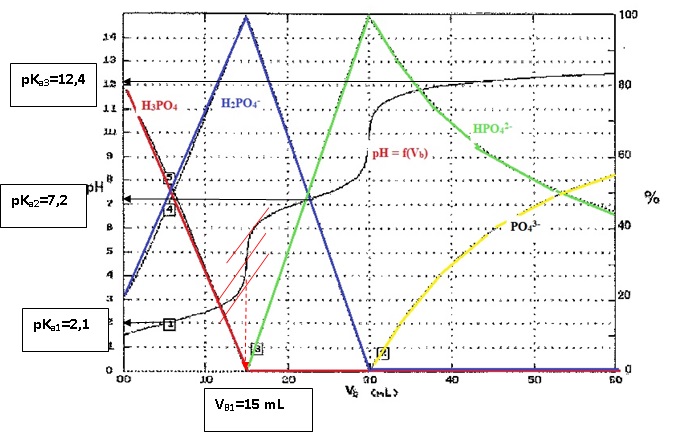
4b. Ecrire les équations des réactions de titrage successives de chaque espèce chimique.
H3PO4aq + HO-aq = H2PO4-aq + H2O(l).
H2PO4-aq+ HO-aq = HPO42-aq + H2O(l).
HPO42-aq + HO-aq = PO43-aq + H2O(l)
4c. Pourquoi
n'observe t-on que deux sauts de pH alors qu'on titre un triacide ?
Justifier en calculant la constante d'équilibre de la réaction de
titrage de la troisième acidité..
La troisième acidité est trop faible pour être dosée : la transformation n'est pas totale à l'équivalence.
K = [PO43-aq] / ([HPO42-aq[HO-aq])=[PO43-aq] [H3O+]/ ([HPO42-aq[HO-aq] [H3O+]) =Ka3 / Ke = 10-12,4 /10-14=101,6 ~40.
4d. Rappeler la relation entre le pH et le pKa. Retrouver graphiquement les pKa des couples de l'acide phosphorique
pH = pKa + log ([A-] / [AH]).
A la demi-équivalence d'un titrage acide base, pH = pKa.
4e. En indiquant la
méthode utilisée, déterminerle volume VBE à la première équivalence. Sa
valeur est-telle cohérente avec les concentrations données ?
La méthode des tangentes donne VBE = 15 mL à la première équivalence.
VBE = C'a Va / Vb =0,15 x10 / 0,1 = 15 mL.
Titrage d'un mélange acide phosphorique acide sulfurique.
Dans un becher de 500 mL, on introduit V = 300,0 mL d'acide sulfurique et on ajoute sous agitation 15,50 g de Ca3(PO4)2. Le volume total est de 300,0 mL. On filtre et sèche le précipité obtenu. On prélève V0 = 10,0 mL du filtrat que l'on dilue 10 fois. On prélève V1 = 20,0 mL de cette solution que l'on titre par une solution d'hydroxyde de sodium de concentration Cb = 0,100 mol/L. On repère deux volumes équivalents à VB1 = 9,0 mL et VB2 = 15,0 mL
La première équivalence correspond au titrage de l'acide sulfurique et
de la première acidité de l'acide phosphorique. La seconde équivalence
correspond au titrage de la seconde acidité de l'acide phosphorique..
5a. Montrer que la quantité de matière d'acide phosphorique présente dans les 20,0 mL s'exprime sous la forme n =Cb( VB2-VB1). Calculer n.
5b. En déduire la quantité de matière d'acide phosphorique formé au cours de la synthèse.
Quantité de matière de soude nécessaire au titrage d'une acidité de l'acide phosphorique :
Cb( VB2-VB1)= 0,100 (15-9)=0,6 mmol.
Quantité de matière d'acide phosphorique dans 20 mL de solution diluée : 0,6 mmol soit 0,6 x5 = 3 mmol dans 100 mL.
3 mmol d'acide phosphorique dans V0 soit 30 x3 = 90 mmol ou 0,09 mol d'acide phosphorique dans V.
5c. Calculer la quantité de matière de Ca3(PO4)2 intoduite puis la quantité de matière théorique d'acide phosphorique obtenu.
M(Ca3(PO4)2)=3 x40,1 +2(31 +4x16) = 310,3 g/mol ; quantité de matière de phosphate de calcium : 15,5 / 310,3 ~0,050 mol.
Quantité de matière d'acide phosphorique formé : 2 x0,05 = 0,1 mol.
5.d. Calculer le rendement de la synthèse.
Quantité de matière réelle / quantité de matière théorique : 0,09 / 0,1 = 0,9 ( 90 %).
|
|