QCM
chimie, concours CPR 2018.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
Partie 1. Structure de la matière,
cinétique chimique. 5
points.
Données :6C ; 17Cl ; 1H ; 8O
; 7N ; 5B ; 9F.
1. Parmi les
configurations suivantes d'atomes neutres, la configuration qui
représente l'état fondamental est :
A.1s2 2s1.
Vrai.
B. 1s2 2s2 2p5 3s1.
C. 1s1 2s2 2p6
3s2.
D. 1s2 2s2 2p6
3s23p6 3d1.
2. Parmi
les molécules suivantes, la molécule qui est polaire est :
A. CCl4. (tétraèdrique).
B. HCN. Vrai.
C CO2 ( linéaire ).
D. BF3.
( triangulaire).
Cinétique chimique.
Le 2-bromooctane C8 H17Br réagit avec les ions
hydroxyde pour former de l'octane-2-ol et des ions bromure selon la
réaction d'équation bilan : C8
H17Br +HO- --> C8 H17OH +Br-.
Initialement les deux réactifs ont la même concentration C. Les ions
bromure sont dosés par argentimétrie. On suppose que la réaction est
globalement du second ordre de constante de vitesse k et on note x = [Br-]
3. La vitesse volumique v de la
réaction s'écrit.
A. v = kx2.
B. v = k(C-x)2.
Vrai.
C. v = - dx /dt.
C. v = -d(C-x)2
/ dt.
4. La loi d'évolution en fonction du
temps, obtenue par intégration de l'équation différentielle cinétique
est :
A. 1 /(C-x )= 1 / C
+kt. Vrai.
B. 1 /(C-x) = 1 /
C-kt.
C. 1 /(x-C) = 1 / C
+kt.
D. 1 /(x-C) = 1 / C
-kt.
v = dx /dt = k(C-x)2
; dx / (C-x)2 = k dt ; 1 /(C-x) = kt + Constante ; à t
= 0 : Constante = 1 / C.
5. A q1 = 25°C, la
valeur k1 de k vaut k1 = 1,36 10-1 mol-1
L s-1 et à q2
= 50 °C, la valeur k2 de k vaut k2 = 1,86
mol-1 L s-1.
L'expression de l'énergie d'activation Ea de la réaction est
:
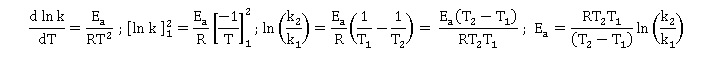
Réponse D.
6. L'énergie
d'activation vaut en kJ mol-1 : 83,7 ; 2,11 ; 79,3 ; 1090.
8,314 x 298 x323 x
ln(1,86 / 0,136) / 25 = 83 700 J mol-1
= 83,7 kJ mol-1.
Chimie des solutions
aqueuses.
Partie 1. Préparation
d'une solution aqueuse à partir d'une solution commerciale.
On veut préparer 1 L de solution aqueuse d'acide chlorhydrique de
concentration molaire CA = 0,025 mol / L à partir d'une
solution commerciale d'acide chlorhydrique ( d = 1,19 ; 38 % en masse).
7. Le volume de
solution commerciale à prélever vaut : ( en mL) : 1 ; 2 ; 10 ; 20.
masse de 1 L de solution
commerciale : 1190 g.
Masse de HCl
correspondante : 1190 x0,38 = 452,2 g.
Concentration : 452,2 /
M(HCl) = 452,2 / 36,5 ~12,4 mol / L..
Facteur de dilution 12,4
/ 0,025 = 496.
Il faut prélever
1000 / 496 ~ 2 mL de solution commerciale.
|
...
|
|
Partie 2. Titrage acido-basique.
Un becher contient VA =20 mL d'une solution aqueuse d'acide
chlorhydrique de concentration CA = 2,5 10-2 mol
/ L. Cette solution est titrée par une solution aqueuse d'ammoniac de
concentration CB = 5 10-2 mol / L. pKa
( NH4+aq / NH3) = 9,2.
8. La
constante d'équilibre associée à l'équation de la réaction de titrage
est : 1014 ; 1,58 109
; 6,3 104 ; 108.
H3O+aq + NH3aq ---> NH4+aq
+ H2O(l).
K = [NH4+aq] / ([H3O+aq][NH3aq
]) avec Ka = [H3O+aq]
[NH3aq ] / [NH4+aq] ;
K =1 /Ka
=109,2 =1,58 109.
9. Le volume de la solution
d'ammoniac nécessaire pour obtenir l'équivalence acido-basique vaut :
10 mL ; 20 mL ; 25 mL ; 30 mL.
VA CA
/ CB = 20 x 2,5 10-2
/ (5 10-2) = 10 mL.
10..
Juste avant l'équivalence (VB < V B éq) ,
l'expression du pH du système réactionnel est :
[H3O+]=(CAVA-CBVB)
/ (VA+VB) = (CBVB
éq-CBVB) / (VA+VB).
pH = - log ( (CBVB éq-CBVB)
/ (VA+VB) ). Réponse A.
11. Pour VB = VB
éq / 2, le pH du système réactionnel vaut : 10 ; 9,2 ; 5,0 ; 2,0 Vrai.
[H3O+]=0,5CAVA
/ (VA+VB)=0,5 x0,025 x20 / (20 +5) =0,01.
12. On néglige
l'influence des ions HO- sur s. Pour VB > VB
éq, l'expression de la conductivité s de la solution s'exprime
en fonction des données du texte et des conductivités molaires ioniques
par la relation :
[Cl
- ]=CAVA
/(VA+VB) ; [H3O+]+[NH4+] =[Cl - ]+
[HO-], solution électriquement neutre.
[H3O+]
et [HO-] sont très inférieures à [Cl - ].
s = (lCl- +lNH4+)CAVA
/(VA+VB). Réponse
C.
Pile plomb / étain
On réalise à 25°C la pile plomb étain avec :
une demi-pile (1) constituée d'une électrode de plomb plongeant dans
une solution contenant des ions Pb2+ de concentration 0,010
mol / L ;
une demi-pile(2) constituée d'une électrode d'étain Sn plongeant dans
une solution contenant des ion étain Sn2+ avec [Sn2+]
= 0,1 mol/L.
Un pont salin assure la liaison électrolytique entre les deux
demi-piles.
Les deux solution ont le même volume.
E°(Pb2+ / Pb) =E°1= -0,13 V. E°(Sn2+ / Sn) =E°2=
-0,14 V.
13. Les potentiels
redox initiaux des deux électrodes valent numériquement :
E(Pb2+/Pb)
= -0,13 + 0,03 log(0,01) = -0.13-0,06 = -0,19 V.
E(Sn2+
/ Sn) = -0,14 +0,03 log (0,1) = -0,14 -0,03 = -0,17 V. Réponse B.
14. L'expression de
la constante d'équilibre K de la raction d'oxydoréduction qui se
produit dans la pile est :
Sn2+aq
+ Pb(s) = Pb2+aq +Sn(s) ; K = [Pb2+aq] /
[Sn2+aq].
E1 = E°1 +0,03 log [Pb2+aq] ; E2
= E°2 +0,03 log [Sn2+aq] ;
à l'équilibre E°1 +0,03 log [Pb2+aq] =E°2
+0,03 log [Sn2+aq]
0,03 log [Pb2+aq]-0,03 log [Sn2+aq] =E°2
- E°1.
log K = (E°2 - E°1) / 0,03.
Réponse D.
15. Les
concentrations en ion Pb2+ et Sn2+ lorsque la
pile ne débite plus sont :
log K = (-0,14 +0,13)
/0,03 = 0,464.
[Pb2+aq]
= 0,01 +x ; [Sn2+aq] =
0,1 -x ; (0,01 +x) / (0,1 -x) = 0,464 ; 0,01 +x = 0,0464 -0,464 x
; x = 0,0249.
[Pb2+aq]
~0,035 mol / L ; [Sn2+aq]
=0,075 mol / L. Réponse D.
|
....
|
Chimie
organique.
L'analyse d'un composé organique X de type CxHyOz
donne les pourcentages massiques suivants ; 41,38 % de carbone, 3,45 %
d'hydrogène. M(X) = 116,05 g / mol
16.
La formule brute de X est :
% en oxygène : 100 -3,45
-41,38 =55,17 %.
12 x / 41,38 = y / 3,45 =
16 z / 55,17 = M = 100 = 1,1605.
z = 1,1605 /16 x55,17 ~4
; y = 1,1605 x 3,45 ~4 ; x = 1,1605 x41,38 / 12 ~4.
C4H4O4.
Réponse D.
17. X peut
subir une bromation. Le titrage du composé X par une solution
d'hydroxyde de sodium met en évidence deux fonctions acides. La formule
du composé X est :
A. HOOC-CH=CH-COOH.
B. CH3-CO-CO-COOH.
C. OCH-CO-CH3-COOH.
D. OCH-CH2-CO-COOH.
Réponse A.
18. Le composé X
présente :
A. deux isomères de position. Faux.
B. deux isomères de fonction. Faux.
C. Des énantiomères. Faux.
D. des diastéréoisomères. Vrai.
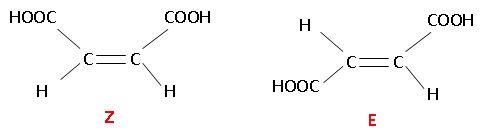
|
|