Chimie,
Concours technicien Douanes
2017.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
Chimie
générale.
Question 1 On
souhaite préparer 100 ml d'une solution d'acide
perchlorique (formule HClO4) à 1 mol/l à partir d'un flacon
commercial
comportant les indications suivantes:
Acide perchlorique 70% ; M 100,46 g/mol ; d = 1,67
a) Déterminer la
concentration en mol/l de la solution commerciale.
Masse de un litre de solution commerciale : 1,67 kg = 1670 g.
Masse d'acide perchlorique : 1670 x 0,70 =1169 g.
Concentration : 1169 / 100,46 ~11,6 mol / L.
b) Déterminer le volume de solution commerciale à déposer dans une
fiole de 100 ml afin de préparer la solution à 1 mol/l.
Fateur de dilution F = 11,6 / 1 = 11,6.
Volume de solution commerciale à prélever : 100 / 11,6 ~8,6 mL.
c) Le chlore est à
l'état naturel constitué de deux isotopes: le chlore
35 et le chlore 37.
Donner la définition d'un isotope.
A quoi correspond le nombre de masse?
A quoi correspond le nombre de charge ou numéro atomique?
Deux isotopes ne différent que par leur nombre de neutrons. Ils
possèdent le même numéro atomique Z.
Le nombre de masse correspond au nombre de nucléons, protons et neutrons.
Le nombre de charge correspond au nombre de protons.
d) Sachant que la
masse molaire moléculaire de l'acide perchlorique est
de 100,46 g/mol, calculer la masse atomique du chlore naturel.
100,46 -1 -16 x 4 =35,46 g/mol.
e) Déterminer l'abondance relative des deux isotopes du chlore.
Soit x l'abondance du chlore 35.
35 x +37(1-x) = 35,46 ; 2x=1,54 ; x = 0,77.
% de chliore 35 : 77 % ; % de chlore 37 : 23 %.
Question 2
L'acide perchlorique est un acide fort.
Déterminer le pH d'une solution à 10-7 mol/l d'acide
perchlorique.
Pour un acide fort : pH = - log(c).
A de telles faibles concentrations, il faut tenir compte des ions H3O+
et HO- issus de l'eau.
A 25°C, H3O+
issus de l'eau est égale à 10-7 mol/L.
H3O+
issus de l'acide perchlorique est égale à 10-7 mol/L.
Soit au total 2 10-7 mol/L ; pH = - log ( 2 10-7)
~6,7.
Question
3.
a) Equilibrer la
réaction d'oxydoréduction suivante en milieu acide.
PbO2 + Mn2+ --> MnO4- +
Pb2+.
Réduction : 5 x{ PbO2 + 4H+ +2e- = Pb2+
+2H2O }
Oxydation : 2 x{ Mn2+
+4H2O--> MnO4- + 8H+ + 5e-}.
Ajouter puis simplifier :
5PbO2 +
20H+ +10e- +2Mn2+ +8H2O=
5Pb2+ +10H2O +2MnO4- + 16H+
+ 10e-.
5PbO2 + 4H+ +2Mn2+
= 5Pb2+ +2H2O +2MnO4-.
b) Equilibrer la réaction
d'oxydoréduction suivante en milieu basique.
Zn + H2O --> HZnO2- + H2.
Oxydation : Zn +3HO- = HZnO2- +2e-+H2O.
Réduction : 2H2O +2e- =H2 +2HO-.
Ajouter
et simplifier : Zn
+HO- +H2O= HZnO2- +H2 .
|
...
|
|
Question 4.
On considère une solution de mercure II à 10-2 mol/l.
a) calculer la concentration en ions iodures quand HgI2 commence à précipiter.
Le pKs de HgI2 est égal à 28.
HgI2(s) = Hg2+aq + 2I-aq.
[Hg2+aq] [I-aq]2 = 10-28 ; [I-aq]2 = 10-28 / 10-2 = 10-26 ; [I-aq] = 10-13 mol/ L.
b) On mélange 100 cm3 de solution de Hg2+ à 10-2 mol/l à 100 cm3 de solution de I- à 10-2 mol/l ; Y-a-t-il formation d'un précipité? Expliquer.
[Hg2+aq] = 10-2 x100 / 200 = 5 10-3 mol/L.
[I-aq] = 10-2 x100 / 200 = 5 10-3 mol/L.
[Hg2+aq] [I-aq]2 =125 10-9.
Cette valeur est supérieure à Ks, HgI2 précipite.
Question 5.
a) Donner les éléments constitutifs d'un appareil de chromatographie en phase gazeuse.
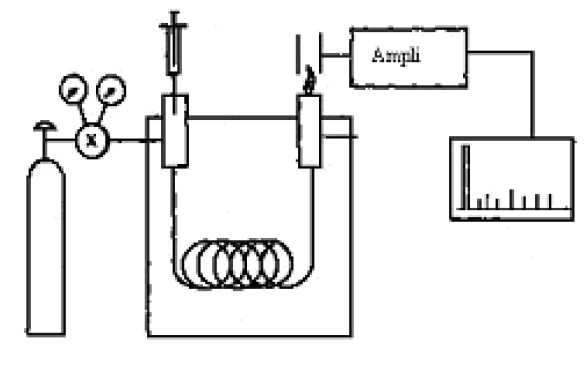
A droite, le gaz vecteur et l'injecteur ; au centre, la colonne placée dans une enceinte thermostatée ; à gauche, le détecteur.
Un
fluide appelé phase mobile parcourt un tube appelé colonne. Cette
colonne peut contenir des "granulés" poreux (colonne remplie) ou être
recouverte à l'intérieur d'un film mince (colonne capillaire). Dans les
deux cas, la colonne est appelée phase stationnaire.
A
l'instant initial, le mélange à séparer est injecté à l'entrée de la
colonne où il se dilue dans la phase mobile qui l'entraîne à travers la
colonne. Si la phase stationnaire a été bien choisie, les constituants
du mélange, appelés généralement les solutés, sont inégalement retenus
lors de la traversée de la colonne.
De
ce phénomène appelé rétention il résulte que les constituants du
mélange injecté se déplacent tous moins vite que la phase mobile et que
leurs vitesses de déplacement sont différentes. Ils sont ainsi élués de
la colonne les uns après les autres et donc séparés.
Un
détecteur placé à la sortie de la colonne couplé à un enregistreur
permet d'obtenir un tracé appelé chromatogramme. En effet, il dirige
sur un enregistreur un signal constant appelé ligne de base en présence
du fluide porteur seul ; au passage de chaque soluté séparé il conduit
dans le temps à l'enregistrement d'un pic.
b) A quel type de molécules s'adresse cet appareil?
Composés gazeux ou susceptibles d'être vaporisés par chauffage sans être décomposés.
c) Indiquer les détecteurs que vous connaissez pouvant s'adapter à cet appareillage en précisant leurs spécificités.
Les catharomètres sont basés sur la conductibilité thermique des gaz. Ils sont peu sensibles ( de l'ordre de 1 à 10 ng).
Les
FID ( détecteur à ionisation de flamme) sont très sensibles ( de 20 à
100 pg). Ils ne conviennent pas aux composés inorganiques.
A capture d'électrons, bien adaptés aux composés halogénés.
Spectrométrie de masse, très sensible et universel.
|
....
|
Question 6.
Effectuer les changements d'unités de façon à obtenir une expression
des résultats avec trois chiffres significatifs sans décimale et avec
si besoin des puissances de 10.
0,0236 mmol / L
|
26,8 µmol / L
|
0,0265 103 nmol/s
|
5,82 102 mg / kg
|
365 000 10-3 µg / mL
|
0,000239 106 nmol / µL
|
480 µmol /s
|
24 10-3 mol/ min
|
236 10-4 mmol /L
= 236 10-7 mol/L
|
268 10-1 µmol/L
= 268 10-7 mol/L
|
26,5 nmol /s
=26,5 10-9 mol /s
=26,5 x60 10-9mol / min
=1,59 10-6 mol / min
|
=582 mg / kg
= 582 10-3 g / kg
=582 10-4 g / 100 g
|
=365 µg / mL
= 365 10-6 g / mL
=365 10-3 g / L.
|
=239 nmol /µL
=239 mmol / L
|
=480 10-6 mol /s
=480 x60 10-6 mol /min
=288 10-4 mol / min
|
=24 103 µmol /min
=24 103/60 µmol / min
=400 µmol / s
|
Question 7.
Le dosage du phosphore s'effectue par minéralisation d'une prise
d'essai à 800°C. Les cendres obtenues sont reprises dans une solution
d'acide sulfurique puis la solution est transférée dans un Erlenmeyer
qui est placé au bain marie à ébullition pendant 30 minutes (hydrolyse
des pyro et polyphosphates). Après refroidissement, la solution limpide
obtenue est transvasée quantitativement dans une fiole jaugée de 100 ml
et complétée avec de l'eau. 10 ml de cette solution S sont ensuite
utilisés pour effectuer le dosage des phosphores par réaction
colorimétrique avec une solution vanadique puis molybdique en milieu
acide. On mesure ensuite l'absorbance de la coloration au
spectrophotomètre à la longueur d'onde de 430 nm.
La gamme de calibration est effectuée dans des fioles de 100 ml de la façon suivante.
a) On désire
effectuer 1 litre de solution étalon à 1,000 g/L de phosphore à partir
d'une poudre pure de dihydrogénophosphate de potassium anhydre.
Déterminer la masse à peser.
1 g / L de phosphore soit 1 / M(P) = 1 / 31 = 0,03223 mol par litre.
M(KH2PO4 ) =39,1 +2 +31 +64 =136,1 g/mol.
Masse à peser : 136,1 x 0,03223~ 4,39 g.
b) Quelle loi physique utilise-t-on pour ce dosage ? Définissez le phénomène. Définissez les termes indispensables.
Loi de Beer-Lambert. A = e L c.
A : absorbance ; e coefficient caractéristique de la substance ; L largeur de la cuve ; c : concentration.
c) Donner la formule de calcul exprimant Cp la concentration de phosphore dans l'échantillon en mg/100 g en fonction de l'Absorbance et de la masse de la prise d'essai Pe en g.
Cp = 104 A.
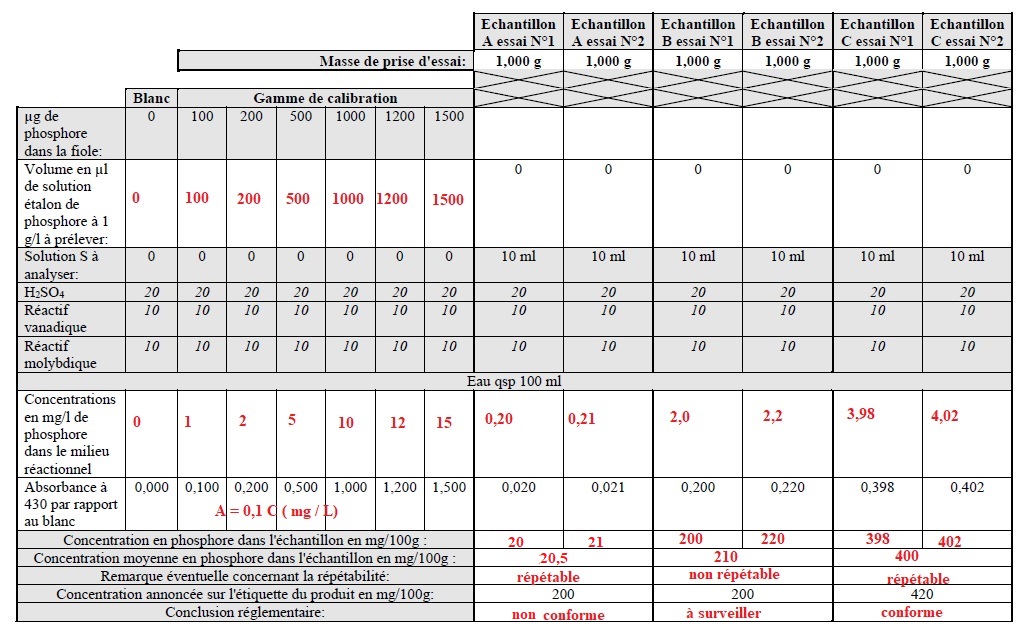
Si la différence entre la concentration indiquée sur l'emballage et la
concentration retrouvée (lors de l'analyse) en mg de phosphore pour 100
g est inférieure à 10%; la conclusion est: Conforme.
Si la différence entre la concentration indiquée sur l'emballage et la
concentration retrouvée (lors de l'analyse) en mg de phosphore pour 100
g est comprise entre 10 et 20%; la conclusion est: A surveiller.
Si la différence entre la concentration indiquée sur l'emballage et la
concentration retrouvée (lors de l'analyse) en mg de phosphore pour 100
g est supérieure à 20%; la conclusion est: Non conforme.
|
Question 8.
Classer les acides suivants par ordre d'acidité croissante:
HCOOH; CH2ClCOOH; CH3COOH; (CH3)3CCOOH; Cl2CHCOOH; CH2BrCOOH; CH3CH2COOH.
Justifier votre réponse.
Cl et Br sont attracteurs et renforcent l'acidité ( l'hydrogène du groupe COOH est plus mobile )
CH3, CH3-CH2 sont donneurs et diminuent l'acidité.
(CH3)3CCOOH < CH3CH2COOH < CH3COOH < HCOOH < CH2BrCOOH < CH2ClCOOH < Cl2CHCOOH
Question 9 .
On fait réagir totalement 4 g d'un hydrocarbure A sur CH3MgBr
en excès. On obtient 2,24 litres de gaz dans les conditions normales de
température et de pression. Sachant que le gaz obtenu est prépondérant
dans les canalisations de gaz de ville, écrire la réaction et en
déduire la formule développée de cet hydrocarbure A.
On obtient 2,24 / 22,4 = 0,1 mol de méthane CH4 à partir de 0,1 mole de A.
Masse molaire de A : 40 g / mol soit C3 H4 ou H3C-C=CH.
H3C-C=CH + CH3MgBr --> CH4 + H3C-C=C- ++MgBr.
|
|
|