Chimie,
école de santé des armées,
concours ESA 2017.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
Etude de l'acide citrique.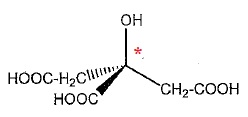
1. Donner le nom de la représentation utilisée ci-dessus.
Représentation de Cram.
2. Définir la notion de carbone asymétrique. Combien la molécule en compte-t-elle ?
Un atome de carbone asymétrique est un atome de carbone tétragonal lié
à 4 atomes ou groupes d'atomes différents. La molécule compte un atome
de carbone asymétrique repéré par *.
3. Définir la notion de chiralité. Cette molécule est-elle chirale ? Justifier.
Une molécule chirale n'est pas superposable à son image dans un miroir
plan. Une molécule possèdant un atome de carbone asymétrique est
chirale.
4. A l'aide de la
représentation ci-dessous, dessiner une autre représentation du même
type obtenue par rotation autour de l'axe repéré en pointillés. Quelle
est alors la relation d'isomérie entre ces deux représentations ?
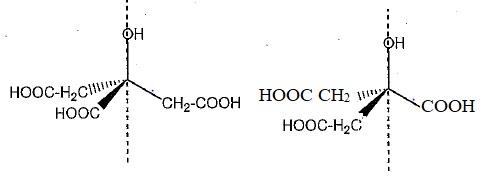
Par rotation autour d'une liaison simple, on obtient deux conformères ( conformations ) de la même molécule.
5.
On veut doser l'acide citrique dans le lait maternel. On réalise un
dosage pHmétrique d'une prise d'essai de 20,0 mL de lait S par une
solution aqueuse d'hydroxyde de sodium de concentration molaire égale à
5,50 10-2 mol/L. L'acide citrique étant un triacide, on le note AH3.
5.a. L'équation de la réaction support du titrage étant la suivante :
AH3 aq + 3HO- aq ---> A3-aq + 3H2O.
Ecrire la relation entre n(AH3) et n(HO-) à l'équivalence.
n(HO-) = 3 n(AH3).
5.b. A partir des courbes ci-dessous, déterminer la concentration molaire en acide citrique dans la solution titrée.
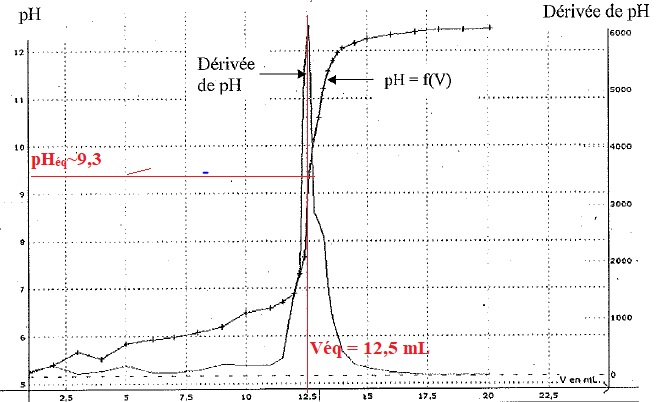
n(HO-) = 12,5 x 2,5 10-2 = 0,3125 mmol.
n(AH3) = 0,3125 / 3 ~0,10 mmol dans 20 mL.
Concentration en acide citrique : 0,10 / 20 = 5 10-3 mol/ L.
5.c. Parmi
les indicateurs colorés ci-dessous, lequel utiliseriez-vous pour ce
titrage ? Justifier et précisez comment l'équivalence est repérée.
Indicateur coloré
|
Teinte acide
|
Zone de virage
|
Teinte basique
|
Hélianthine
|
rouge
|
3,1 - 4,4
|
jaune
|
Vert de bromocrésol
|
jaune
|
3,8 - 5,4
|
bleu
|
Bleu de bromothymol
|
jaune
|
6,0- 7,6
|
bleu
|
Phénolphtaléine
|
incolore
|
8,2 - 12
|
rose
|
Rouge d'alizarine
|
violet
|
10,0 - 12
|
jaune.
|
Le pH du point
équivalent ( ici 9,3) doit appartenir à la zone de virage de
l'indicateur coloré. La phénolphtaleine convient. Avant l'équivalence
la solution est incolore ; après l'équivalence, la solution est rose.
.
|
|
|
|
Etude du lactose du lait maternel.
Le lactose est un disaccharide constitué d'une molécule de galactose liée à une molécule de glucose.
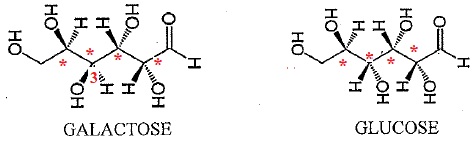
1. Pour chacune de ces deux molécules, donner le nombre d'atomes de carbone asymétriques.
Chaque molécule compte 4 atomes de carbone asymétriques.
2. Parmi les
relations suivantes, laquelle ou lesquelles caractérise(n) correctement
la relation entre le galactose et le glucose. Justifier.
Seul l'atome de carbone n°3 n'a pas la même configuration. Le galactose et le glucose sont deux diastéréoisomères.
isomères de constitution ; stéréoisomères de configuration ; stéréoisomères de conformation ; énantiomères ;
diastéréoisomères Z / E .
3.
A l'état libre, le galactose peut se cycliser sous la forme d'un
galactopyrannose. On sait que ce mécanisme implique le carbone n°1 et
la fonction portée par le carbone n°5.
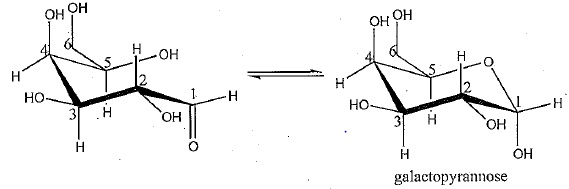
3a Nommer
le groupe caractéristique et la fonction portés par le carbone n°1.
Indiquer la polarisation de la liaison C=O. Justifier.
Groupe carbonyle et fonction aldehyde. L'oxygène étant plus
électronégatif que le carbone, le carbone porte une charge partielle
positive et l'oxygène une charge partielle négative.
3b Nommer le groupe caractéristique et la fonction portés par le carbone n°5. Indiquer la polarisation de la liaison O--H. Justifier..
Groupe hydroxyle OH et fonction alcool secondaire.
L'oxygène étant
plus électronégatif que l'hydrogène, ll'hydrogène porte une charge
partielle positive et l'oxygène une charge partielle négative.
3c.
Reproduire le schéma ci-dessous et : entourer et préciser les sites
accepteurs et donneurs d'électrons impliqués dans la formation de la
nouvelle liaison carbone-oxygène ; à l'aide d'un minimom de flèches
courbes, expliquer la formation de cette nouvelle liaison.
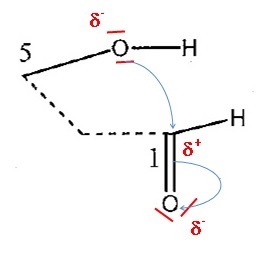
3d. Déterminer la catégorie de la réaction parmi : substitution, addition ou élimination.
Addition sur la liaison double C=O.
4.
La lactase est une enzyme qui permet de digérer le lactose en
l'hydrolysant en glucose et galactose. Expérimentalement, on hydrolyse
le lactose à 37°C en présence de lactase et on suit l'évolution de
l'avancement x de la réaction en fonction du temps sur la courbe 1.
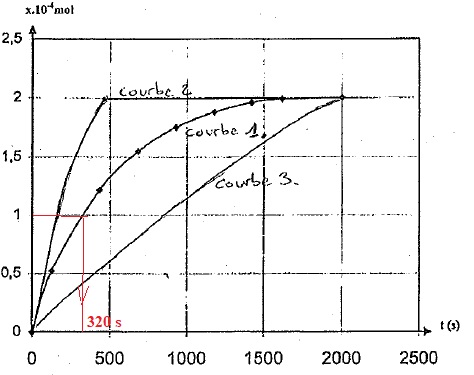
4a. Définir le temps de demi-réaction. Le calculer à partir de la courbe1.
A t½, l'avancement est égal à la moitié de l'avancement final ; t½ = 320 s.
4.b La lactase peut
être inhibée par l'ajout dans le milieu de thiolactose molécule qui
ressemble au lactose mais qui une fois fixée par l'enzyme ne peut pas
être hydrolysée. Prédire quelle courbe pourrait correspondre à cette
situation dans laquelle on aurait ajouté du thiolactose au milieu.
Justifier.
Courbe 2 : t½ est inférieur à 320 s, l'hydrolyse est plus rapide, elle s'effectue, par exemple, à température plus élevée.
Courbe 3 : t½
est proche de 900 s, l'hydrolyse est moins rapide, par exemple,
inhibition de la catalase. Cette courbe correspond à l'ajout de
thiolactose.
|
|
|
|
|
Les acides aminés du lait : leucine et isoleucine.
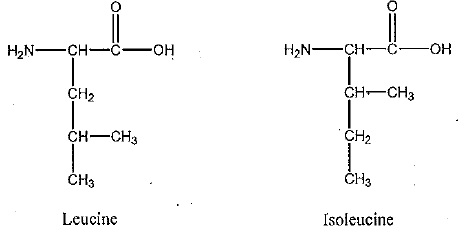
1. Sachant que pKa (RCOOH / RCOO-) = 2,3 et pKa (R' NH3+ / R' NH2) = 9,8, indiquez les espèces de la leucine qui prédominenet en solution en fonction du pH du milieu.
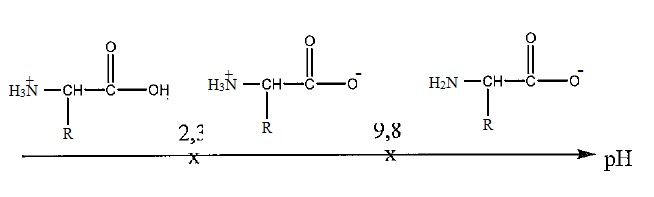
2 En déduire la formule semi-développée de la leucine à pH = 7,4.
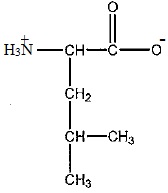
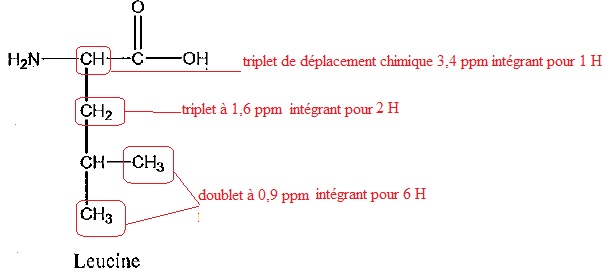
3 On réalise les spectres RMN du proton de chaque acide aminé.
L'un deux comporte les caractéristiques suivantes :
un doublet de déplacement chimique 0,9 ppm intégrant pour 6 H ;
un multiplet non résolu de déplacement chimique 1,5 ppm intégrant pour 1 H ;
un triplet de déplacement chimique 1,6 ppm intégrant pour 2 H ;
un triplet de déplacement chimique 3,4 ppm intégrant pour 1 H ;
un singulet de déplacement chimique 4,5 ppm intégrand pour 2 H ;
un singulet de déplacement chimique 10 ppm intéhrant pour 1 H.
Ce spectre est-il celui de la leucine ou de l'isoleucine ? Justifier.
|
|
Le singulet de déplacement chimique 4,5 ppm intégrand pour 2 H correspond à NH2.
Le singulet de déplacement chimique 10 ppm intéhrant pour 1 H correspond à COOH.
|
|
|