Des
isotopes du carbone pour détecter les fraudes, Capes
physique chimie
2016.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
De
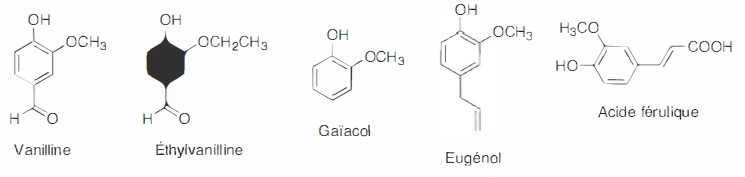
nombreux produits alimentaires sont parfumés à la vanille. La vanilline
est le composant le plus important et le plus caractéristique parmi les
constituants multiples de l'arôme naturel de vanille ; sa formule brute
est C8H8O3, sa masse molaire M= 152 g/mol.
La vanilline naturelle est un aldehyde aromatique qui se développe dans
les gousses de vanille. Les gousses contiennent environ 2,5 % en masse
de vanilline.
La vanilline synthétique est obtenue grâce à différents procédés
chimiques à partir de composés organiques comme le ga<îacol ou
l'eugénol. Des procédés de bioconversion utilisnt la lignine ou l'acide
férulique.
L'éthylvanilline est un composé de synthèse. Elle a un pouvoir
aromatique 2 à 4 fois supérieur à celui de la vanilline naturelle ou
synthétique.
45. Identifier les groupes caractéristiques présents dans la vanilline.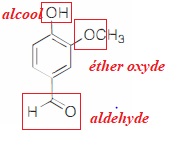
1. Synthèse historique de la vanilline à partir de l'eugénol.
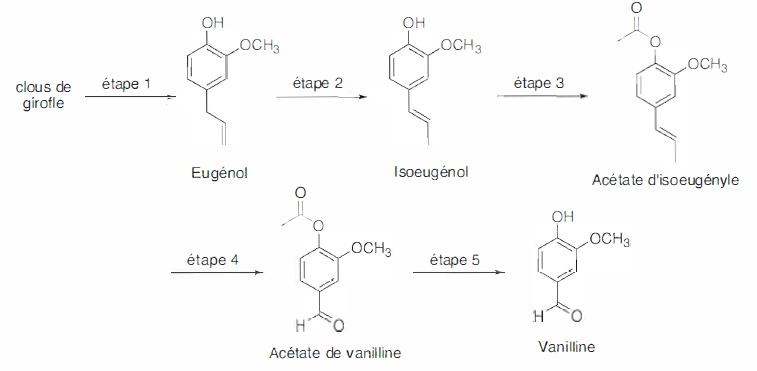
Dans l'étape 1, l'hydrodistillation de clous de girofle donne un
distillat trouble qui, après traitement, conduit à une huile qui
contient majoritairement de l'eugénol.
46. Dessiner le schéma annoté du montage d'hydrodistillation. Expliquer en quelques lignes cette technique d'extraction.
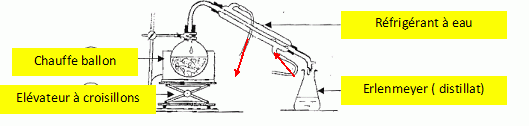
On
distille le mélange hétérogène eau + produit naturel ; on récupère un
mélange eau + composé organique qui bien souvent surnage.
47. Pourquoi le distillat obtenu est-il trouble ?
Le
distillat contient beaucoup d'eau et des gouttes d'huile essentielle (
non miscibles à l'eau) de clous de girofle en suspension.
48. Proposer une technique d'identification de l'eugénol ainsi extrait.
Chromatographie sur couche mince.
L'eugénol s'isomérise en milieu basique en isoeugénol ( étape 2). La soude sert de catalyseur.
49. Expliquer pourquoi l'équilibre chimique entre l'eugénol et l'isoeugénol est favorable à l'isoeugénol.
Dans l'isoeugénol l'alcène est plus substitué. Il est donc plus stable ( règle de Zaitsev).
50. Proposer un mécanisme pour cette isomérisation en milieu basique.
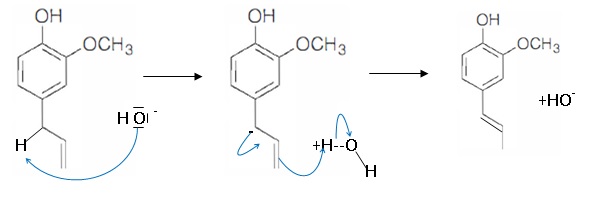
Trois étapes permettent d'accéder à la vaniliine.
51. Proposer des réactifs et des conditions opératoires pour les étapes 3, 4 et 5 de la synthèse de la vanilline.
Etape 3. chauffage à reflux, agitation , réaction entre l'isoeugénol et l'anhydride éthanoïque.
Etape 4. oxydation à froid, sous agitation, réaction entre l'acétate d'isoeugénol et le permanganate de potassium.
Etape 5 : agitation, chauffage à reflux, hydrolyse acide de l'ester.
52. Expliquer la stratégie développée dans cette synthèse.
On protège le groupe hydroxyle OH de l'eugénol avant d'effectuer
l'oxydation de la fonction alcène. Cette oxydation doit conduire à
l'aldehyde et non pas à l'acide carboxylique. Puis on déprotège le
groupe hydroxyle par hydrolyse acide.
|
...
|
|
2. Distinction entre vanilline et éthylvanilline.
Vu
le prix de revient élevé de la vanille naturelle, elle est très souvent
remplacée par de l'éthylvanilline, produit par synthèse dont le pouvoir
aromatisant est plus élevé que celui de la vanilline. Les premières
fraudes constatées consistaient à remplacer la vanilline par de
l'éthylvanilline.
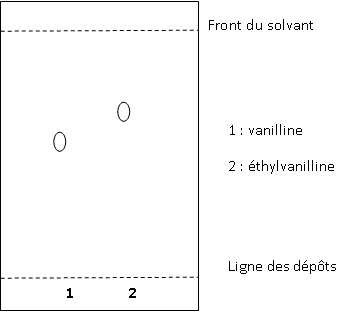
Une simple chromatographie sur couche mince suffit pour faire la
distinction ente l'éthylvanilline et la vanilline. Sur une plaque de
silice avec un mélange acétate d'éthyle - cyclohexane ( 1 / 1 en
volumes ) comme éluant, on obtient les résultats suivants : Rf (
vanilline) = 0,64 et Rf(éthylvanilline) = 0,77 où Rf est le rapport
frontal.
53. Dessiner à l'échelle, le chromatogramme que l'on obtiendrait si on réalisait une CCM avec les deux substances pures.
La spectroscopie RMN du proton permet également de différentier nettement l'éthylvanilline et la vanilline.
54. Quelle(s) différence(s) remarquable(s) observerait-on entre ces deux spectres ?
Vanilline : le grpoue CH3 donne un singulet.
Ethylvanilline : le groupe CH2-CH3 donne deux signaux.
un quadruplet (CH2, trois protons portés par le carbone voisin) et un triplet ( CH3, deux protons portés par le carbone voisin ).
|
....
|
3. Distinction entre vanilline naturelle et vanilline de synthèse.
Le carbone 14 est radioactif ß-.
Demi-vie du carbone 14 : t½ = 5,73 103 ans.
Une des première méthodes de distinction était fondée sur le fait
que la vanilline obtenue à partie des gousses de vanille naturelles
présentait une radioactivité liée au carbone 14 plus élevée que celle
issue de sources pétrochimiques. Un produit synthétique a une teneur en
carbone 14 nulle du fait de son origine pétrolière, alors qu'un produit
naturel a une teneur en carbone 14 proche de la teneur atmosphérique
actuelle ( 1,2 10-12).
55. Définir la notion d'isotope et l'illustrer à l'aide d'exemples sur le carbone.
Des isotopes ne diffèrent que par leur nombre de neutrons. Ils ont le même numéro atomique.
126C , 136C, 146C.
56. Calculer la variation relative de carbone 14 d'un échantillon animal ou végétal pendant une durée de 100 ans.
Loi de décroissance radioactive : A = A0 exp(-l t) avec l = ln2 / t½ =ln2 / (5,73 103) ~1,21 10-4 an-1.
(A0-A) / A0 = 1-exp(-1,21 10-4 x100) = 0,012 ( ~1,2 %).
On pourra considérer que cette variation est négligeable sur une durée inférieure ou égale à 100 ans.
Un échantillon de 1,00 g de vanilline d'origine inconnue soumis à
analyse présente une radioativité liée au carbone 14 de 2,52 DPM / g(
désintégrations par minute et par gramme).
57.
En déduire la proportion de vanilline naturelle dans cet
échantillon si on suppose que la vanilline de synthèse présente dans
l'échantillon ne présente aucune radioactivité liée au carbone 14.
Activité correspondante : 2,52 / 60 = 0,042 Bq.
l = ln2 ( 5,73 103 x365 x24 x3600) =3,84 10-12 s-1.
Nombre de noyaux de carbone 14 : N = A / l = 0,042 / (3,84 10-12)=1,095 1010.
Nombre de mole de carbone 14 : 1,095 1010 / (6,02 1023) =1,82 10-14 mol.
Masse de carbone 14 : 1,82 10-14 x14 = 2,55 10-13 g.
Proportion de carbone 14 dans l'échantillon : 2,55 10-13 /(1,2 10-12) =0,21.
Proportion de vanilline naturelle : ~21 %.
L'analyse radiochimique permet de distinguer la vanilline
naturelle de la vanilline de synthèse à partir de dérivés du pétrole.
Elle différencie donc aisément la vanilline naturelle et la vanilline
synthétisée à partir du gaïacol, dérivé du benzène issu de l'industrie
pétrochimique. Cette méthode ne donne cependant aucun résultat probant
pour la vanilline synthétisée à partir de produits naturels comme
l'eugénol, la lignine ou l'acide férulique. Il faut alors utiliser un
autre isotope du carbone, le carbone 13 ( abondance naturelle ~1,3 %).
La proportion de carbone 12 et de carbone 13 ( rapport
isotopique) dans une molécule renseigne sur son origine ( animale ou
végétale, naturelle ou synthétique).
La spectrographie de masse associée à une chromatofgraphie en phase
gazeuse est un outil classique d'analyse isotopique. Une étude a permis
de déterminer le rapport isotopique de tois vanilline d'origine
différentes.
|
Vanilline naturelle ( vanille Bourbon )
|
Vanilline de synthèse ( gaïacol)
|
Vanilline de synthèse ( eugénol)
|
13C / 12C ppm
|
10996,7
|
10869,7
|
10891,1
|
d13C ( ) ( pour mille ° /°°)
|
- 21,4
|
- 32,7
|
- 30,8
|
On utilise habituellement la déviation isotopique, notée d13C ( exprimée en %) par :
d13C=(13C / 12C) échantillon -13C / 12C) référence ) / 13C / 12C) référence .
13C / 12C) référence = 11237,2 ppm.
58. Calculer
la déviation isootopique pour les trois vanillines précédentes.
Justifier que la déviation isotopique est une grandeur plus appropriée
pour comparer deux écchantillons.
Cette métrhode est plus performante que celle du carbone 14. Elle
permet de distinguer la vanilline naturelle des vanillines obtenues par
synthèse ou par hémisynthèse.
|
|





