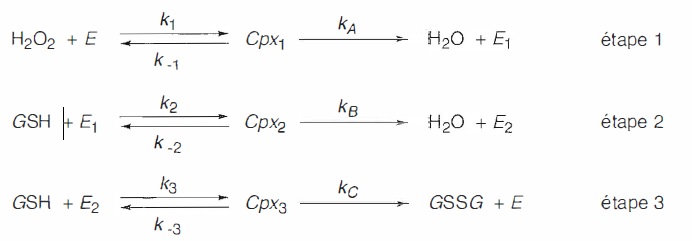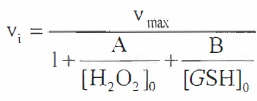Le
sélénium, un oligoélément, Capes physique chimie
2016.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
......
.....
|
Le
sélénium est un élément chimique de la famille des chalcogènes, de
symbole Se et de numéro atomique 34. Par son abondance terrestre très
faible ( environ 0,000005 en masse ), le sélénium est un élément rare
présent à l'état de traces dans les sulfures naturels.
1. Donner les principaux états ( nombres ou degrés ) d'oxydation prévisibles pour le sélénium.
Structure électronique : 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p4 soit [Ar] 3d10 4s2 4p4.
Les nombres d'oxydation du sélénium peuvent être :
-II : [Ar] 3d10 4s2 4p6.
+IV : [Ar] 3d10 4s2.
+VI : [Ar] 3d10 .
Les couches électroniques externes sont alors complètes.
2. Expliquer la facilité de remplacement du soufre par le sélénium dans les sulfures naturels.
Le soufre ( Z = 16) et le sélénium appartiennent tous deux à la
famille des chalcogènes ( structure électronique externe en s2 p4 ). Ces deux éléments forment donc des composés analogues.
Le sélénium est un oligoélément qui se trouve à l'état de traces dans
le corps humain ( 0,00002 % en masse ). Il entre dans la chaîne
alimentaire par l'intermédiaire des plantes qui le captent dans le sol.
Une carence en sélénium est responsable de la maladie de Keshan. En
ajoutant à la nourriture un supplément de sélénite de sodium ( solide
ionique de formule Na2SeO3) ou de séléniate de sodium ( solide ionique de formule Na2SeO4), on éradique la maladie.
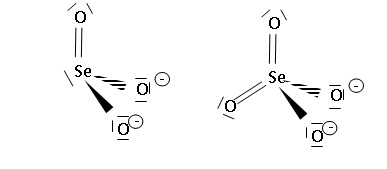
3.
Proposer des schémas de Lewis pour les ions sélénite et séléniate
sachant que l'atome de sélénium est central. Prévoir la structure
géométrique de ces deux ions.
Ion sélénite SeO32-; modèle VSEPR AX3 E, pyramide à base triangulaire.
Ion séléniate SeO42-; modèle VSEPR AX4 .
Les formes organiques, où le sélénium est associé à la cystéine ou à la
méthionine sont plus facilement assimilables par l'organisme que les
formes minérales. La sélénocystéine et la sélénométhionine sont les
principales sources de sélénium dans l'alimentation.
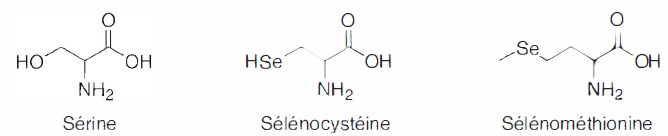
4.1 Repprésenter la molécule de (R)-sélénocystéine.
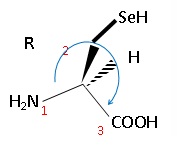
4.2.
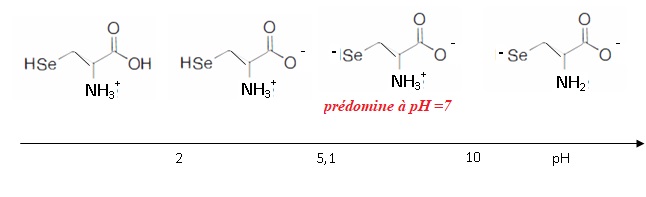
Les pKa de la sélénocystèine valent (2,0 ; 5,2 , 10). Sachant que 5,2
correspond au pKa du groupe sélénol, établir un diagraamme de
prédominance en fonction du pH en précisant les formules des
différentes espèces. Quelle est la forme prédominante à pH biologique ?
|
...
|
|
La dégradation de la séléniométhionine in vivo génère du séléniure d'hydrogène de formule H2Se.
5. A l'aide de justifications succinctes pais récises, rendre compte des différences entre :
- les température d'ébullition sous 1 bar de l'eau et du séléniure d'hydrogène.
- les moments dipolaires des molécules d'eau et de séléniure d'hydrogène.
Le sélénium est moins électronégatif que l'oxygène. Par conséquence :
- le moment dipolaire de H2Se est inférieur à celui de H2O, les liaisons H-Se étant moins polarisées que les liaisons H-O ( le soufre est moins électronégatif que l'oxygène).
- la température d'ébullition de H2Se est inférieure à celle de H2O, les liaisons hydrogène entre molécules H2Se étant moins fortes que les liaisons hydrogène entre molécules d'eau.
Les ions séléniures provenant du séléniure d'hydrogène sont transformés en ions sélénophosphate SePO33-
" donneurs de sélénium", utilisés pour convertir la sérine en
sélénocystéine. La sélénocystéine est une coenzyme de la gluthation
peoxydase, enzyme séléniée qui catalyse les réactions de décomposition
du peroxyde d'hydrogène H2O2 en eau et deshydroperoxydes organiques ROOH en alcool ROH par le glutathion au sein des cellules.
6. Définir une enzyme.
Une enzyme est une protéine, catalyseur d'une réaction biochimique spécifique.
On pose les notations suivantes :
GSH pour la forme réduite du glutathion ( G est la notation abrégée
d'un groupe, S et H désignent les atomes de soufre et d'hydrogène ).
GSSG pour la forme oxydée du glutathion ( G est la notation abrégée du même groupe que dans GSH, S désigne l'atome de soufre ).
E pour le glutathion peroxydase.
La destruction du peroxyde d'hydrogène par le glutathion, catalysée par
le glutathion peroxydase, se fait suivant un mécanisme de type " ping
pong "décrit ci-dessous. Le peroxyde d'hydrogène est fixé par l'enzyme
et transforme ( étape 1). Cette première réaction modifie l'enzyme de
manière à permettre les étapes 2 et 3 avec la forme réduite du
glutathion, qui est alors transformé.
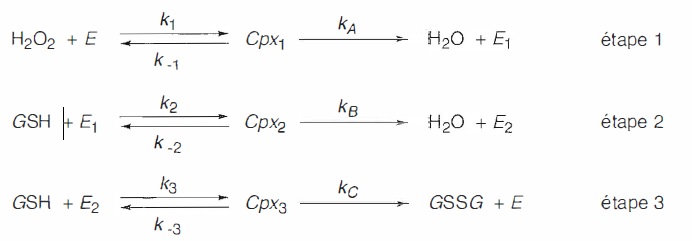
Dans ces réactions, les Cpxi ( avec i = 1, 2 et 3) sont des complexes enzyme-substrat formés à partir de H2O2 et GSH et les Ei sont des formes modifiées de l'enzyme E. Les ki sont des constantes de vitesse.
7. Ecrire l'équation globale correspondant à ce mécanisme.
H2O2 + 2GSH ---> 2H2O + GSSH.
8. Si
on adopte la notation R-SeH ( R est la notation abrégée d'un groupe, Se
et H désignent les atomes de sélénium et d'hydrogène) pour l'enzyme E,
donner les notations des formes modifiées E1 et E2 de l'enzyme.
E1 : R-Se OH ; E2 : R-Se SG.
9. En utilisant le mécanisme proposé, associer à chaque numéro de la figure ci-dessous une espèce.
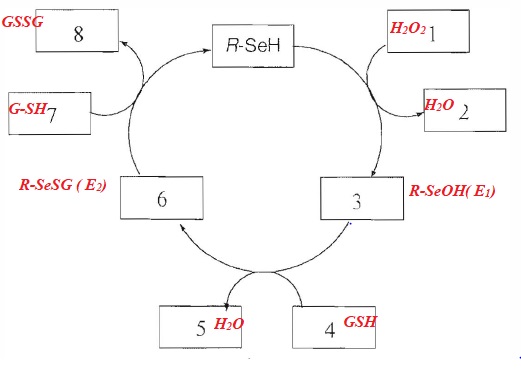
|
....
|
On admet que l'on peut appliquer l'approximation des états quasi-stationnaires aux complexes enzyme-substrat Cpx1, Cpx2 et Cpx3.
10. Exprimer la concentration du complexe Cpx1 en fonction des concentrations molaires en E et H2O2 et les constantes de vitesse adéquates.
d[Cpx1] /dt = 0 = k1(H2O2] [E]- k-1[Cpx1]-kA[Cpx1].
[Cpx1]=k1(H2O2] [E] /(k-1+kA).
10. Ecrire la relation qui traduit la conservation de l'enzyme.
d[E]/ dt +d[E1] / dt + d[E2 ) / dt = 0.
La vitesse de la réaction est donnée par :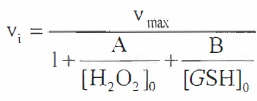
avec vi : vitesse volumique initiale de formation de GSSG.
vmax : limite de vi quand les concentrations initiales [H2O2]0 et (GSH]0 deviennent très grandes.
A et B : constantes positives qui dépendent des constantes de vitesses.
12. Proposer une unité pour A et B.
A et B ont la dimension d'une concentration volumique, le dénominateur étant sans unité. A et B s'exprime en mol Ll-1.
13.
La constante A s'appelle constante de Michaelis pour H2O2 à GSH saturant. Expliquer pourquoi.
Lorsque GSH est saturant, le terme B / [GSH]0 est négligeable. La vitesse ne dépend alors que de A et [H2O2]0.
Des
études cinétiques de la réaction de l'eau oxygénée avec le glutathion,
catalysée par la glutathion peroxydase ont été menées. Les conditions
expérimentales mises en oeuvre ainsi que les représentations graphiques
( régressions linéaires ) des résuktats obtenus sont données.
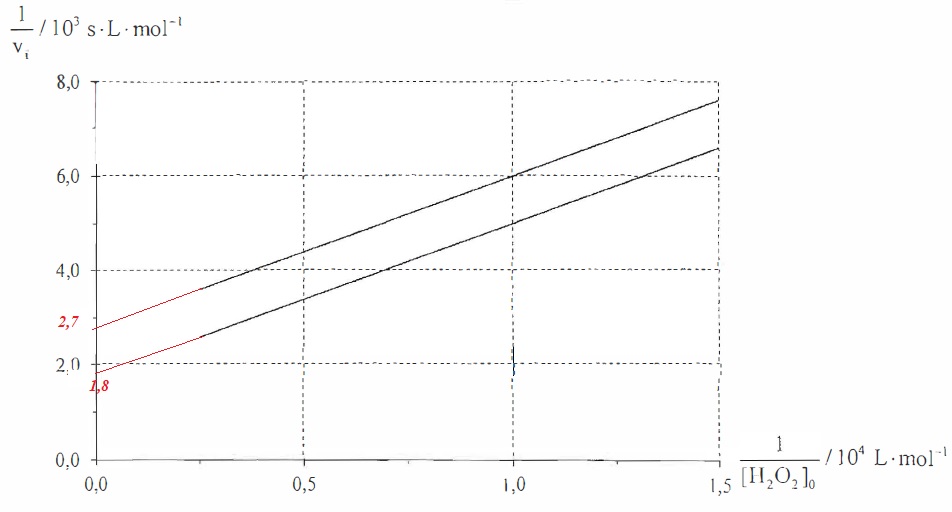
Conditions : milieu tamponné pH = 6,7 ; [E]0 = 5,3 10-8 mol / L.
Courbe supérieure : [GSH]0 = 1,5 10-2 mol / L.
Courbe inférieure : [GSH]0 = 3,0 10-2 mol / L.
14. Pourquoi la transformation est-elle efectuée en milieu tamponnée ?
La
catalyse enzymatique ( plus précisément la géométrie de l'enzyme)
dépend du pH. Il est donc nécessaire d'avoir un pH constant.
15. Déterminer les valeurs expérimentales de vmax, A et B à partir de la figure.
1 / v = (1 + A /[H2O2]0 + B / [GSH]0) / vmax.
Coefficient directeur de ces droites : 2 103 / (1-0,375) 104) = 0,32 s.
Pour la courbe supérieure : 1 / v = (1 + A /[H2O2]0 + B / (0,015) / vmax.
1 / v = (A / vmax ) / [H2O2]0 +(1+B/0,015) / vmax.
Par suite : A / vmax =0,32. (1)
Ordonnée à l'origine : 2,7 103 = (1+66,7 B) / vmax.(2)
Pour la courbe inférieure : ordonnée à l'origine : 1,8 103 = (1+33,3 B) / vmax. (3).
(2) / (3) donne : 1,5 (1 +33,3 B) = 1 +66,7 B, soit B = 0,027 mol/ L.
(2) donne : vmax =(1 +66,7 x0,027) /(2,7 103) ~ 1,0 10-3 mol L-1 s-1.
(1) donne : A = 0,32 x1,010-3 =3,3 10-4 mol / L.
|
|