Spectroscopie,
microscope, dosage des chlorures,
BTS Bioanalyses et contrôles 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
Dosage
d'une solution de bleu de méthylène.
On souhaite déterminer avec précision la concentration du colorant
d'une solution X dont l'étiquette porte l'indication " bleu de
mathylène 1,0 g L-1".
On note Cx la concentration en bleu de méthylène de cette
solution. Cette concentration est déterminée par spectrophotométrie.
On mesure l'absorbance A d'une solution de bleu de méthylène pour
différentes longueurs d'onde.
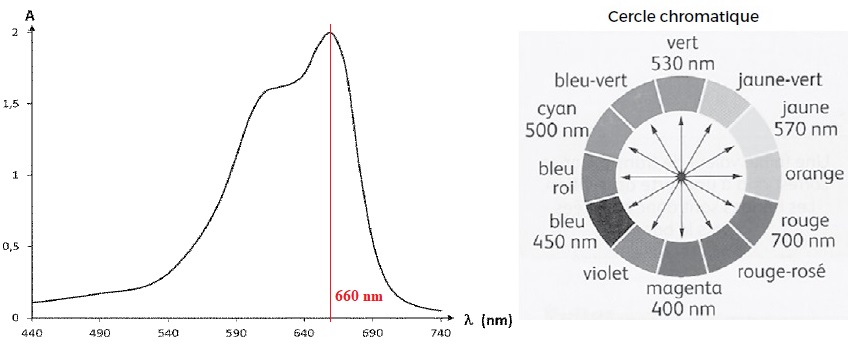
Question 1 :
1.1. Déterminer la
longueur d'onde correspondant au maximum d'absorption.
Environ 660 nm, couleur orangée.
1.2 Justifier la
couleur de la solution de ce colorant.
La teinte de la solution est le bleu, couleur complémentaire de
l'orangé.
2.
Une solution mère de bleu de méthylène est diluée 10 fois et à partir
de celle-ci on réalise une gamme de solutions filles de concentrations CF..
Les résultats des mesures d'absorbance sont donnés.
Numéro
de la solution fille
|
1
|
2
|
3
|
4
|
5
|
Concentration
massique ( mg / L)
|
0,50
|
1,0
|
2,0
|
3,0
|
4,0
|
Absorbance
A
|
0,058
|
0,126
|
1,243
|
0,374
|
0,488
|
2.1. Ecrire l'expression littérale
de la loi de Beer, nommer chaque grandeur et en donner l'unité SI.
A= e l c.
c : concentration mol m-3. l : largeur de la cuve (m); A :
absorbance ; e :
coefficient d'absorpttion molaire (m2 mol-1).
2.2. Justifier ,
sans calcul, que la courbe suivante est en accord avec la loi de Beer.
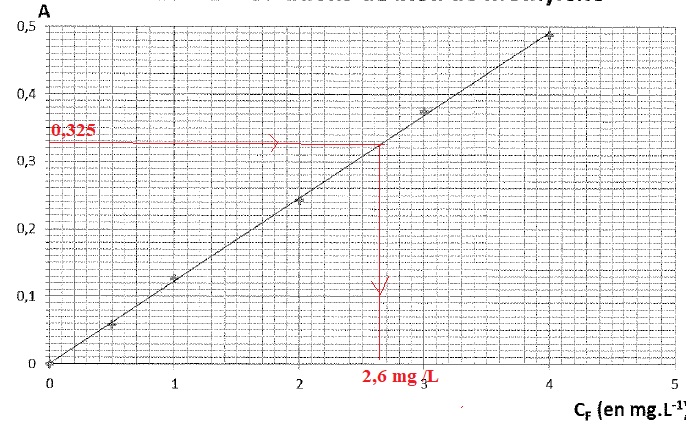
La courbe est une droite passant par l'origine, en accord avec la loi
de Beer.
3. Une solution SD
de bleu de méthylène a été obtenue en diluant 400 fois la solution X.
La mesure de l'absorbance donne AD = 0,325.
3.1 Déterminer
graphiquement la concentration CD de la solution SD.
2,6 mg / L.
3.2. En déduire la
concentration Cx de la solution X.
Cx = 400 CD = 400 x 2,6 =1040 mg / L = 1,04 g / L.
3.3. Cette valeur
confirme t-elle l'étiquetage ?
Oui, l'écart relatif est de l'ordre de (1,04-1) / 1 x100 = 4 %.
|
|
Observation
d'une levure au microscope..
Longueur de la levure AB = 8,0 10-6 m.
Observation à l'oeil nu.
L'objet est placé à la distance minimale de vision distincte de l'oeil,
dm = 25 cm.
1.1. Montrer que le
diamètre apparent de l'objet est a
= 3,2 10-5 rad.
a = AB
/ dm = 8,0 10-6 / 0,25 = 3,2 10-5 rad.
1.2. Le pouvoir séparateur de l'oeil
est égal à 3 10-4 rad. Justifier que la levure ne peut pas
être observée à l'oeil nu.
Le diamètre apparent de la levure est inférieur au poivoir séparateur
de l'oeil. La levure ne peut pas être observée à l'oeil nu.
Observation au microscope.
Ce microscope est modèlisé par
l'association de deux lentilles convergentes centrées sur le même axe
optique.
L'objectif L1 ( centre optique O1, distance
focale f '1 = 5,00 mm) donne de l'objet AB une image
intermédiaire A1B1.
L'oculaire L2 (
centre optique O2, distance focale f '2 = 2,00
cm) donne de l'image intermédiaire, une image définitive A'B'.
La distance D = F'1F'2
( intervalle optique) entre l'oculaire et l'objectif est fixe
Le grandissement de l'objectif est |g1| = D / f '1.
2.1.1. Indiquer la
position de l'image A'B' pour une observation sans fatigue de l'oeil
normal.
L'oeil observe sans fatique un objet se trouvant à l'infini.
2.1.2. Donner dans
ce cas la position de l'image intermédiaire.
L'image intermédiaire se trouve au foyer objet de l'oculaire.
2.1.3. Schématiser
ce modèle de microscope, sans souci d'échelle.
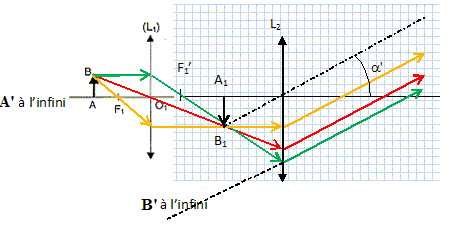
2.2. L'objet AB est à 5,14 mm devant
l'objectif.
2.2.1. Montrer que O1A1
= 18,4 cm.
2.2.2. Montrer que
l'intervalle optique vaut 17,9 cm.
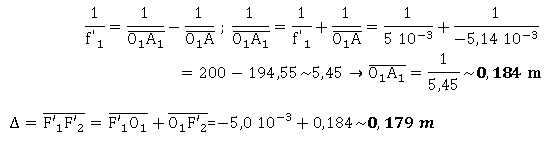
2.2.3.En déduire la
valeur du grandissement de l'objectif.
0,179 / (5 10-3) =35,6.
2.3. Le
grossissement commercial du microscope est égal à Gc=450.
Calculer a'.
a' =Gc
xAB / 4 = 450 x8 10-6 / 4 = 9 10-4 rad.
Cette valeur étant supérieure au pouvoir séparateur de l'oeil, la
levure AB est visible au travers le microscope.
|
|
Dosage des ions chlorures contenus dans un
sérum physiologique..
Concentration
massique en chlorure de sodium indiquée sur une dose de sérum
physiologique : 9,0 g / L à 5 % près.
La solution titrante est du nitrate d'argent et l'indicateur coloré de
fin de réaction l'ion chromate CrO42-.
Etude de la précipitation sélective des
ions chlorure.
Produit de solubilité : Ks(AgCl) = 1,8 10-10 ; Ks(Ag2CrO4)
= 1,2 10-12.
On considère un mélange contenant des ions chlorure de concentration C1
= 0,150 mol / L et d'ion chromate de concentration C2 =
0,059 mol /L.
Dans ce mélange, on vers eune solution aqueuse contenant des ions
argent. Deux précipités peuvent se former, le chlorure d'argent AgCl et
le chromate d'argent Ag2CrO4
de couleur rouge.
1.1. Ecrire
l'équation de la réaction de formation du chlorure d'argent et donner
l'expression littérale de son produit de solubilité.
Ag+aq +Cl- aq ---> AgCl(s). Ks(AgCl) = [Ag+aq
]
[ Cl-
aq ]
1.2. Montrer que
lorsque le chlorure d'argent commence à précipiter, la concentration en
ion argent dans le milieu réactionnel est [Ag+]1=1,2
10-9 mol / L.
[Ag+aq
]
=
Ks(AgCl) /
[ Cl-
aq ]
= 1,8 10-10 / 0,150 = 1,2
10-9 mol / L.
1.3.
Lorsque le chromate d'argent commence à précipiter dans le mélange
précédent, la concentration en ion argent dans le milieu réactionnel
est [Ag+]2=4,5
10-6 mol / L. Retrouver cette valeur par un calcul. En
déduire que AgCl précipite en premier.
2Ag+aq
+CrO42-
aq ---> Ag2CrO4.
Ks(Ag2CrO4)
= [Ag+aq
]2
[ CrO42-
aq
].
[Ag+aq
]2
=1,2
10-12 / 0,059 = 2,03 10-11 ; [Ag+]2=4,5
10-6 mol / L.
[Ag+]1 < [Ag+]2
, le chlorure d'argent précipite en premier.
Dosage des ions chlorure
dans un sérum.
Dans
un erlenmeyer, on introduit V1 = 5,0 mL de sérum et V2
= 0,10 mL de solution aqueuse de chromate de potassium de concentration
C2 = 3,00 mol / L
On dose ce mélange
par une solution de nitrate d'argent de concentration C' = 0,050 mol /
L.
2.1. Définir
l'équivalence du dosage.
A l'équivalence les réactifs sont en proportions stoechiométriques.
Avant l'équivalence Ag+ est en défaut, après l'équivalence Ag+
est en excès.
2.2. Véq
= 16,0 mL. Montrer que la concentration C en ion chlorure contenus dans
le sérum physiologique est 0,16 mol / L.
A l'équivalence : C V1 = Véq C ' ; C = Véq C ' / V1
=16,0 x0,05 / 5,0 = 0,16 mol /L.
2.3. En déduire la
concentration massique en chlorure de sodium dans le sérum.
C x M(NaCl) = 0,16
x58,5 =9,36 g / L.
2.4 Ce résultat
estèil cohérent avec la valeur lue sur l'étiquette ? Justifier.
Ecart relatif : (
9,36-9) / 9 x100 = 4 %, valeur inférieure à 5 %. Les résultats sont
cohérents.
Synthèse de l'anthranilate de méthyle à partir du benzène.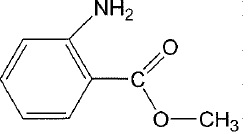
1. Première étape.
L'action du chlorométhane CH3Cl sur le benzène conduit à un composé A de formule semi-développée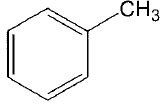
Ecrire l'équation de la réaction. Nommer A. Donner le nom d'un catalyseur fréquemment utilisé pour cette réaction.
Parmi les termes suivants, choisir celui ( ou ceux ) qui caractérise(nt) la transformation étudiée.
addition ; électrophile ; élimination ; nucléophile ; radicalaire ; substitution.
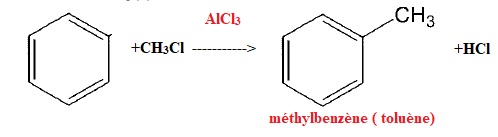
Substitution électrophile.
Deuxième étape.
La nitration de A permet d'obtenir minoritairement le composé B' et majoritairement B majoritaire.
Donner le(s) réactif(s) nécessaire(s) à la nitration de A. Donner la formule semi-développée de B.
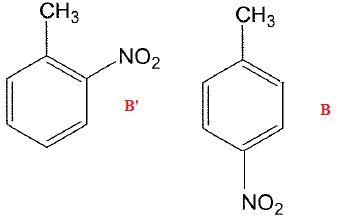
Les réactifs sont les acides sulfurique et nitrique concentrés.
Troisième étape.
L'oxydation par les ions permanganate en milieu acide de B' conduit à C, l'acide 2-nitrobenzoïque.
Ecriire l'équation de la réaction d'oxydo-réduction mise en jeu.
MnO4- +8 H+ +5e- ---> Mn2+ + 4H2O.
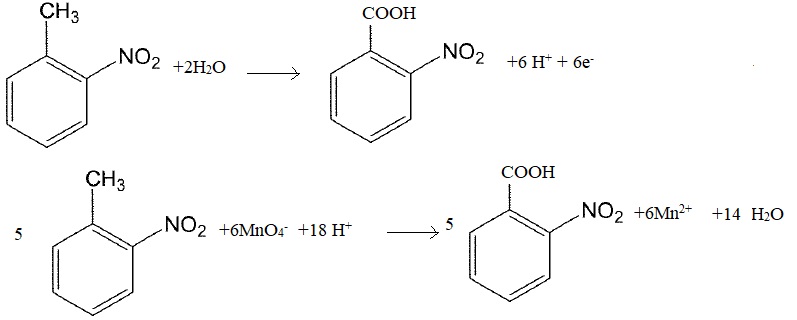
Quatrième étape.
Le composé C est réduit par le dihydrogène en présence de carbonate de cuivre (II) afin d'obtenir D.
Entourer et nommer les fonctions chimiques présentes et nommer l'acide anthtanilique en nomenclature officielle.
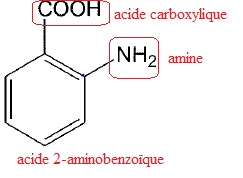
Cinquième étape.
D réagit avec le méthanol en milieu acide pour donner l'antrhranilate de méthyle.
Ecrire l'équation de la réaction. Nommer cette réaction. Citer deux
caractéristiques de cette réaction. Proposer une façon d'augmenter le
rendement.
Réaction d'estérification lente et limitée par l'hydrolyse de l'ester.
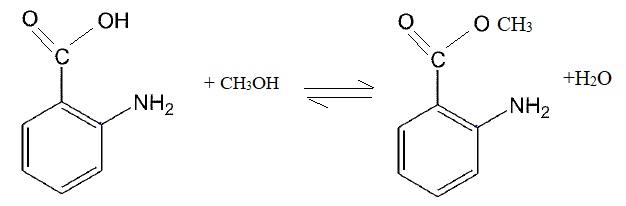
Pour augmenter le rendement, on peut mettre un réactif en excès ( le
méthanol par exemple ) ou éliminer l'eau au fur et à mesure de sa
formation.
|
|