La
consommation mondiale de chewing-gums est d'un demi kilogramme par
personne et par an, les Français étant les deuxièmes consommateurs au
monde, derrière les Américains.
Voici quelques informations figurant sur une boîte de chewinggums à la
fraise.
Ingrédients.
Édulcorants : sorbitol, maltitol, xylitol, sirop de maltitol,
aspartame, acésulfame-K.
Gomme base.
Agent de charge : E341ii.
Stabilisant : E414.
Arômes.
Acidifiant : E300.
Émulsifiant : lécithine de tournesol.
Agent d'enrobage : E903.
Colorant : E120.
Conseil et information.
Conserver à l’abri de la chaleur et de l’humidité.
Contient une source de phénylalanine.
Dans cet exercice, trois ingrédients de ce chewing-gum sont étudiés :
un arôme, un édulcorant et le colorant E 120.
1. Arôme de fraises.
Une fraise naturelle contient plus de 300 espèces chimiques ayant des
propriétés aromatiques. Pour reproduire le goût fraise, on ne
synthétise que celles qui sont les plus marquantes. Parmi elles, on
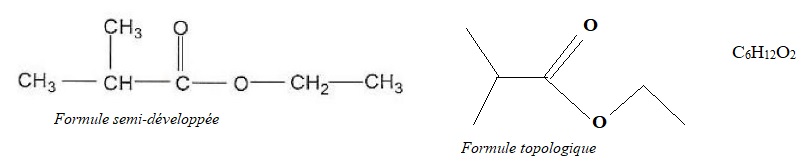
trouve l'espèce A dont la formule est donnée ci-dessous et qui
peut être synthétisée au laboratoire.
1.1. Quel est le
type de la formule représentée ? Donner la formule brute et la formule
topologique de cette molécule (espèce A).
 1.2
1.2. Choisir le nom
de l’espèce A dans la liste suivante : méthanoate de méthylpropyle,
2-méthylpentanol, butanoate d'éthyle, acide 2-
méthylpentanoïque, 2-méthylpropanoate d'éthyle, éthanoate de
méthylpropyle, 2-méthylpentanamide. Justifier.
La partie gauche de la molécule est issue de l'acide
2-méthylpropanoïque et la partie droite de l'éthanol ; d'où le nom de
cet ester 2-méthylpropanoate d'éthyle.
1.3. Cette molécule
possède-t-elle des stéréoisomères de configuration ? Justifier.
La molécule ne possède ni double liaison C=C, ni carbone asymétrique,
elle ne possède pas d'isomères de configuration.
Le début du protocole permettant de synthétiser cette espèce au
laboratoire est décrit cidessous.
Introduire dans un ballon :
0,2 mol d'acide 2-méthylpropanoïque ;
de l'éthanol en quantité stoechiométrique ;
quelques gouttes d'acide sulfurique concentré ;
quelques billes de verre.
Chauffer à reflux pendant 30 minutes.
Données
Équation de la réaction de synthèse
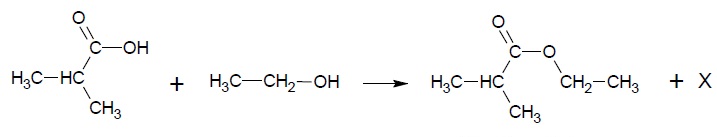 1.4.
1.4. Identifier
l'espèce chimique notée X dans l'équation de la réaction.
Molécule d'eau H
2O.
1.5. Quelles sont
les consignes de sécurité à mettre en place pour effectuer cette
synthèse en toute sécurité ? Justifier.
L'acide sulfurique est corrosif et l'éthanol est inflammable : port de
blouse, gants, lunette de protection et travailler en absence de flamme.
1.6. Dans cette
synthèse, l'acide sulfurique est un catalyseur et la catalyse est
homogène. Expliquer l’expression « catalyse homogène ».
Le catalyseur accélère une réaction chimique thermodynamiquement
possible. Il est régénéré lors de la dernière étape du mécanisme
réactionnel. Catalyseur et réactifs se trouvent dans la même phase : la
catalyse est homogène.
1.7. Déterminer le
volume d'éthanol à ajouter pour que le mélange réactionnel soit
stoechiométrique.
M = 46 g / mol ;
r
= 0,79 g / mL.
0,2 mol soit 0,2 x46 = 9,2 g ou 9,2 / 0,79 = 11,6 mL ~ 12 mL.