Qualité de
l'eau du robinet, Bac ST2S Antilles 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
Exercice 1 : Qualité de l'eau du robinet (7,5
points)
Les
programmes de contrôle de la qualité de l’eau du robinet donnent lieu,
chaque année, à la réalisation de plus de 12 millions d’analyses, ce
qui fait de cette eau la denrée alimentaire la plus contrôlée en
France. La surveillance de l'eau, orchestrée par la Direction Générale
de la Santé (DGS), porte sur des paramètres microbiologiques,
physico-chimiques ou radiologiques et permet de s’assurer que les eaux
mises en distribution ne présentent pas de risque pour la santé des
consommateurs.
Partie 1 : Radioactivité de l'eau du robinet.
L’Institut de Radioprotection et de Sureté Nucléaire (IRSN) est chargé
plus particulièrement de l'analyse de la qualité radiologique de l'eau
du robinet.
1. Expliquer le terme isotope.
Deux isotopes ne diffèrent que par leur nombre de neutrons. Ils ont le même numéro atomique Z.
2. Donner la composition du noyau de radium 226.( 22688 Ra ).
88 protons et 226-88 =138 neutrons.
3. L'équation de désintégration du radium 226 en radon 222 s'écrit :
22688 Ra ---> 22286 Rn+ AZX.
3.1.
Recopier l'équation de désintégration en identifiant la particule X et
en déterminant son nombre de masse et son nombre de charges.
Énoncer les lois de conservation utilisées.
2688 Ra ---> 22286 Rn+ 42He ( noyau d'hélium).
Conservation de la charge : 88 = 86 + Z soit Z = 2.
Conservation du nombre de nucléons : 226 = 222 + A soit A = 4.
3.2. Préciser le type de radioactivité de cette désintégration.
Radioactivité de type alpha.
3.3. Rappeler la définition de la période radioactive ou demi-vie d’un isotope radioactif.
La période radioactive est la durée au bout de laquelle la moitié des noyaux initiaux se sont désintégrés.
3.4. La période
biologique d’un élément chimique est le temps au bout duquel, la moitié
d’une quantité ingérée est éliminée de l’organisme. On considère que
l’élimination est totale au bout de 20 périodes biologiques. La période
biologique du radium 226 est d’environ 900 jours.
Justifier que l’activité du radium 226 n’est pas notablement modifiée pendant son séjour dans l’organisme.
La demi-vie du radium est d'environ 1600 ans, valeur très supérieure à 20 périodes biologiques ( 900 x20 / 365 ~ 49 ans).
Partie 2 : Une technique pour éliminer les micropolluants.
Les prélèvements réalisés par les organismes de contrôle de la qualité
de l'eau sont souvent effectués après la station d'épuration. Lorsque
ces contrôles montrent la persistance de micropolluants, des techniques
de traitements complémentaires sont utilisées pour les éliminer. La
désinfection par rayonnement UV fait partie de ces techniques.
Données : Énergie transportée par un photon E = h c / l.
Avec h = 6,62 × 10-34 J·s et c = 3,00 × 108 m·s-1.
L'efficacité maximale de la désinfection UV est atteinte lorsque les photons émis ont une énergie voisine de 7,80 × 10-19 J.
1. Préciser ce que signifie le sigle UV.
ultra violet.
2. Citer une source de rayonnement UV.
Le soleil.
3. Compléter le
diagramme de l'annexe à rendre avec la copie, en attribuant à chaque
zone A et B, le nom qui correspond au type de rayonnement.
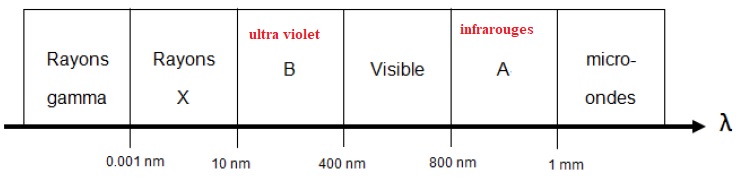
4. Montrer que pour une efficacité maximale de la désinfection UV, la longueur d'onde du rayonnement utilisé vaut environ l = 255 nm.
Donnée : 1 nm = 10-9 m.
l = hc / E = 6,62 10-34 x3,00 108 /(7,80 10-19) =2,55 10-7 m = 255 nm.
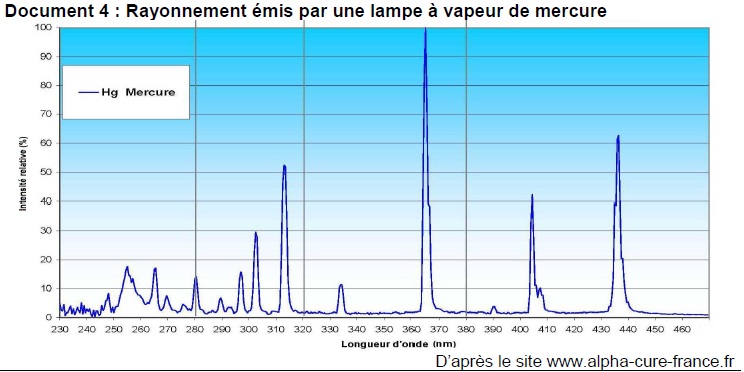
5. Justifier, à l’aide du document 4, que l’utilisation d’une lampe à vapeur de mercure permet d’éliminer les micro-organismes.
Cette lampe émet des radiations de longueur d'onde 255 nm. Elle est donc efficace.
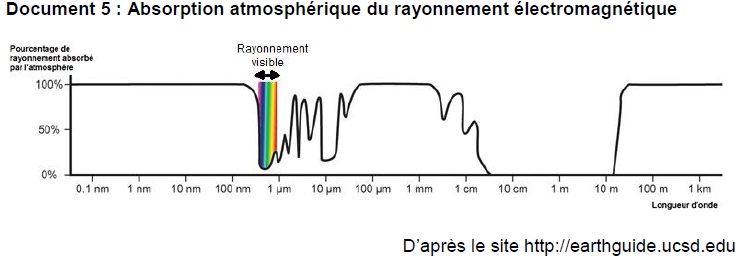
6. Indiquer si le
rayonnement solaire permet l’élimination des micro-organismes de l’eau
des rivières. Justifier la réponse en utilisant le document 5.
L'atmosphère absorbe le rayonnement UV de longueur d'onde 255 nm. Le
rayonnement solaire ne permet pas d'éliminer les micro-organismes de
l'eau des rivières.
|
|
|
|
|
Exercice 2 : Pollution de l'eau (6,5
points)
Les
micropolluants que l'on retrouve parfois à la sortie des stations de
traitement proviennent des substances rejetées dans l’eau après usage.
Ils y demeurent présents à l’état de traces mais, même à faible
concentration, ces composés minéraux ou organiques peuvent présenter
des risques pour la santé : 82 % de ces traces sont des métaux, 15 %
des substances pharmaceutiques et 3% des savons.
Le palmitate de sodium de formule (C15H31-- COO– + Na+)
fait partie des savons que l'on retrouve parfois à la sortie des
stations de traitement. Les qualités détergentes de ce savon
proviennent des propriétés de l'ion palmitate C15H31-- COO–.
1. L'ion palmitate présente une structure particulière, il possède une partie hydrophile et une partie hydrophobe.
1.1. Définir le terme hydrophile.
Qui possède une affinité pour l'eau ( ami de l'eau).
1.2. Recopier la formule de cet ion et indiquer clairement les pôles hydrophile et hydrophobe.
C15H31-- : partie hydrophobe ; COO– : partie hydrophile.
1.3. Montrer que la chaîne carbonée [C15H31--] est saturée.
Pour une chaine saturée à 15 atomes de carbone, le nombre d'hydrogène est égal à 2 x15 +1 = 31. Cette chaine carbonée est donc saturée.
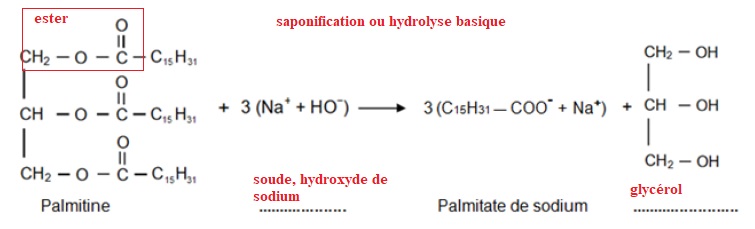
2. Le
palmitate de sodium est synthétisé en laboratoire à partir de la
palmitine, un triglycéride, selon la réaction se trouvant sur l'annexe
à rendre avec la copie.
2.1. Préciser le nom associé à ce type de réaction.
2.2. Compléter les noms manquants des espèces chimiques impliquées dans cette réaction sur l'annexe à rendre avec la copie.
3. Sur la formule
chimique de la palmitine écrite dans l’équation de la réaction donnée
en annexe à rendre avec la copie, entourer puis nommer les groupes
caractéristiques.
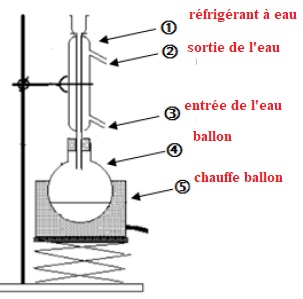
4. Au laboratoire, pour synthétiser ce savon, on utilise le dispositif suivant :
4.1. Nommer le type de montage utilisé et en expliquer l’intérêt.
Le chauffage à refflux permet d'accélérer la réaction tout en évitant
les pertes de matière. Les vapeurs se condensent dans le réfrigérant et
retombent dans le milieu réactionnel.
4.2. Associer aux numéros une légende choisie parmi : ballon, chauffe-ballon, réfrigérant, entrée d’eau, sortie d’eau.
4.3. La réaction
est supposée totale. On fait réagir 2 moles de palmitine. Indiquer la
quantité de matière de palmitate de sodium obtenu.
On obtient six moles de palmitate de sodium.
4.4. Calculer la masse de palmitate de sodium solide (C15H31COONa) obtenue.
Masse molaire du palmitate de sodium : M =16 x12 +31 +2 x16 +23 = 278 g / mol.
m = 6 x278 =1668 g~1,7 kg.
|
|
Exercice
3 : Analyse de l'eau du robinet (6 points)
Il cherche à déterminer la concentration en ions hydrogénocarbonate HCO3-
de cette eau. Pour cela, il réalise un dosage pH-métrique d’un
prélèvement de 100 mL par un acide fort (que l'on notera AH) et dont la
concentration est CAH = 0,020 mol·L-1.
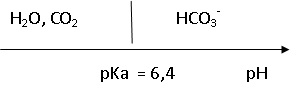
Données : Couple acido-basique (CO2, H2O) / HCO3- pKa = 6,4 ; M (HCO3- ) = 61 g·mol-1.
1. Donner la définition d'un acide selon Brönsted.
Un acide est une espèce, ion ou molécule, susceptible de céder un proton H+.
2. Tracer le diagramme de prédominance du couple CO2, H2O) / HCO3- .
3.
Expliquer, à l'aide des premiers résultats du technicien, pourquoi les
ions hydrogéno- carbonate sont majoritaires dans l'eau à doser.
Le pH de l'eau est égal à 7,2, valeur supérieure au pKa du couple CO2, H2O) / HCO3- . A pH > pKa, l'ion HCO3- est majoritaire.
4. Pour réaliser le dosage, le technicien prépare le montage ci-dessous.
Choisir parmi le matériel proposé, ce qu’il doit rajouter au montage pour réaliser le dosage pH-métrique.
- Fiole jaugée de 100 mL ; - Bécher de 150 mL ; - Burette graduée de 25
mL ; - Éprouvette graduée de 100 mL ; - Pipette jaugée de 20 mL
- Propipette ; - pH-mètre ; - Chauffe-ballon
 Il doit rajouter une burette graduée de 25 mL et un pH=mètre.
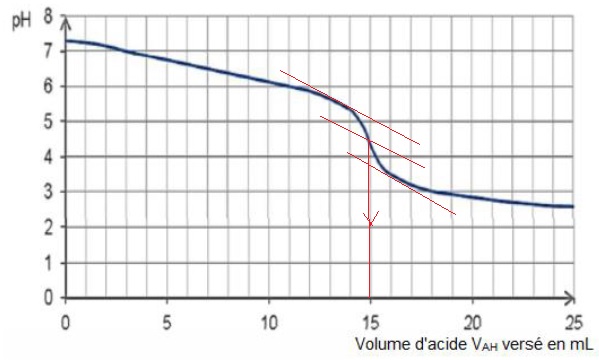
5. On note VAH le volume d'acide versé. En traçant pH = f (VAH) on obtient le graphique ci-dessous. Vérifier à l’aide de ce graphique que le volume versé à l'équivalence est VE = 15 mL. Faire apparaître les traits de construction sur le document.
Il doit rajouter une burette graduée de 25 mL et un pH=mètre.
5. On note VAH le volume d'acide versé. En traçant pH = f (VAH) on obtient le graphique ci-dessous. Vérifier à l’aide de ce graphique que le volume versé à l'équivalence est VE = 15 mL. Faire apparaître les traits de construction sur le document.
6. L’équation chimique de la réaction acido-basique mise en jeu au cours de ce dosage est :
HCO3- + AH ---> A – + (CO2 , H2O)
6.1. Montrer que la quantité de matière d’ions hydrogénocarbonate dosée vaut :
n (HCO3-) = 3,0 × 10-4 mol.
A l'équivalence, n (HCO3-) =CAH VE = 0,020 x 15 10-3 = 3,0 × 10-4 mol.
6.2. Calculer la concentration massique en ions hydrogénocarbonate de cette eau.
3,0 × 10-4 / 0,100 = 3,0 10-3 mol / L.
6.3. Cette eau est-elle conforme à la réglementation en vigueur ?
Masse d'ion hydrogénocatnonate dans 1 L d'eau :
3,0 10-3 x M (HCO3- ) =3,0 10-3 x 61 = 0,183 ~0,18 g / L = 1,8 102 mg / L.
Cette valeur étant inférieure à 600 mg / L, cette eau respecte la norme.
|
|