Des bonbons
salés à la réglisse, Bac S métropole 09/2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
Dans
la tradition des pays nordiques, les bonbons à la réglisse contiennent
un solide ionique (chlorure d’ammonium) qui leur confère un goût
particulièrement salé et piquant.
Des élèves ont pour objectif de vérifier la valeur du pourcentage
massique en chlorure d’ammonium indiqué sur l’étiquette du paquet de
bonbons ci-dessous.
Données :
masse molaire du chlorure d’ammonium NH4Cl : M = 53,5 g.mol-1 ;
équation de la réaction de dissolution du chlorure d’ammonium dans l’eau :
NH4Cl (s) → NH4+ (aq) + Cl −(aq)
pKa du couple (NH4+/NH3) à 25 °C : pKa = 9,2 ;
conductivités molaires ioniques ( mS m2 mol-1) à 25 °C :
ion
|
hydroxyde HO-
|
chlorure Cl-
|
ammonium NH4+
|
sodium Na+
|
s
|
19,8
|
7,7
|
7,3
|
5,0
|
pourcentage massique d’une espèce X dans un mélange : 100 × m(X) / m(mélange)
où m(X) et m(mélange) sont respectivement les masses de l’espèce X et du mélange.
Protocole suivi par les deux groupes d’élèves :
- Étape 1 : Dissoudre un bonbon de masse 1,0 g dans une fiole jaugée de
volume 250,0 mL complétée avec de l’eau distillée. On obtient la
solution S0.
- Étape 2 : Prélever 40,0 mL de S0.
- Étape 3 : Réaliser un titrage de ce prélèvement par une solution aqueuse d’hydroxyde de sodium
(Na+(aq)+HO −(aq)) de concentration molaire 1,00 × 10-2 mol.L-1.
La réaction support du titrage a pour équation : NH4+(aq) + HO −(aq) → NH3(aq) + H2O
1. Expliquer pourquoi la réaction support du titrage est qualifiée d’acido-basique en précisant les couples mis en jeu.
Il y a un échange de proton entre l'ion ammonium et l'ion hydroxyde.
Un premier groupe d’élèves (groupe A) choisit de réaliser un titrage
acido-basique suivi par pH-métrie, un second groupe (groupe B) réalise
un titrage acido-basique suivi par conductimétrie.
2. Titrage suivi par pH-métrie
Les élèves du groupe A tracent l’évolution du pH en fonction du volume
de solution d’hydroxyde de sodium versé. Ils obtiennent la courbe
suivante.
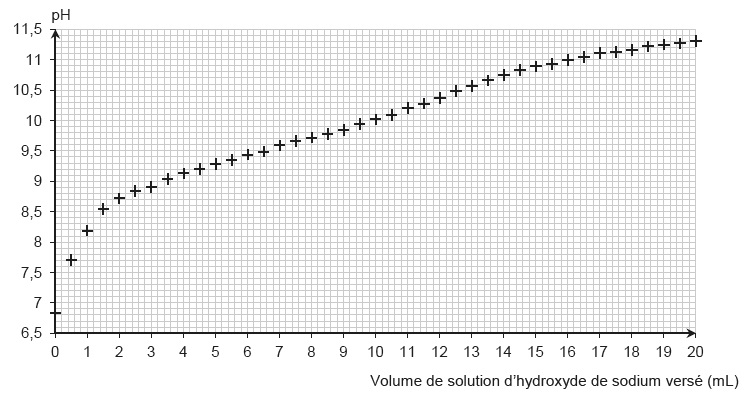
2.1. À l’aide de la figure, déterminer l’espèce prédominante du couple NH4+/NH3 au début et à la fin du titrage. Justifier.
Le pH initial est voisin de 7, inférieur au pKa de ce couple, l'ion ammonium prédomine.
Le pH final est voisin de 11, supérieur au pKa de ce couple, NH3 prédomine.
2.2. En déduire que la transformation chimique décrite par l’équation de la réaction du titrage a bien eu lieu.
NH4+est minoritaire et NH3 est majoritaire à la fin du titrage. La réaction du titrage a bien eu lieu.
2.3. Indiquer pourquoi ce graphique ne permet pas de déterminer le pourcentage massique en chlorure d’ammonium.
A l'équivalence, le saut de pH est très peu marqué.
|
|
|
|
|
Afin d’obtenir une courbe exploitable, le professeur fournit aux élèves les résultats des deux simulations données ci-dessous.
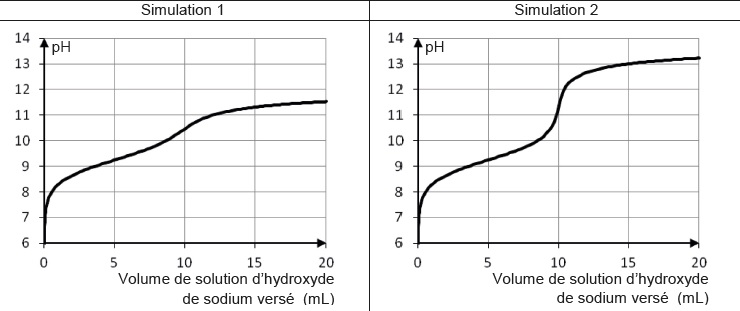
Simulation 1 du titrage de 10,0 mL d’une solution aqueuse de chlorure d’ammonium de concentration 1,00 × 10-2 mol.L-1 par une solution
aqueuse d’hydroxyde de sodium de concentration 1,00 × 10-2 mol.L-1.
Simulation 2 du titrage de 10,0 mL d’une solution aqueuse de chlorure d’ammonium de concentration 0,500 mol.L-1 par une solution aqueuse d’hydroxyde de sodium de concentration 0,500 mol.L-1.
2.4. Quel(s) paramètre(s) faut-il faire évoluer pour rendre la courbe de suivi pH-métrique exploitable ?
Il faut faire croître de manière importante les concentrations des deux solutions.
2.5. Proposer
une(ou des) modification(s) du protocole expérimental suivi par les
élèves du groupe A afin de rendre la courbe de titrage par suivi
pH-métrique directement exploitable.
On observe un saut de pH important si le pH final est proche de 13 ;
soit une concentration des solutions voisin de 0,50 mol/L ( 50
fois plus grande que 0,010 mol/ L).
Étape 1 : Dissoudre des bonbons de masse 10,0 g dans une fiole jaugée de
volume 50,0 mL complétée avec de l’eau distillée.
.
|
|
3 . Titrage suivi par conductimétrie
Les élèves du groupe B prélèvent à leur tour 40,0 mL de la solution S0
et réalisent le titrage suivi par conductimétrie. Ils tracent
l’évolution de la conductivité en fonction du volume versé de solution
d’hydroxyde de sodium de concentration molaire 1,00 × 10-2 mol.L-1. Ils obtiennent la courbe suivante :
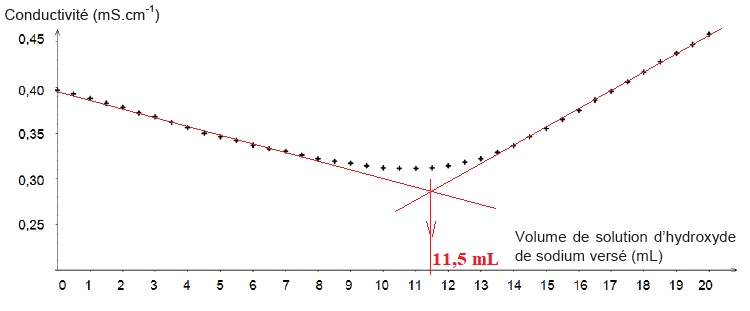
3.1. Interpréter qualitativement le changement de pente observé sur la courbe et déterminer le volume équivalent.
Avant l'équivalence , l'ion hydroxyde est en défaut : du point de vue
de la conductivité, tout se passe comme si on remplaçait l'ion ammonium
par l'ion sodium de conductivité molaire ionique moindre. La
conductivité de la solution diminue.
Après l'équivalence, l'ion hydroxyde est en excès : on ajoute des ions
hydroxyde et sodium à la solution ; sa conductivité croît.
3.2. En déduire que
le pourcentage massique en chlorure d’ammonium dans le bonbon est
proche de l’indication donnée par l’étiquette du paquet. (4,2 % de
chlorure d'ammonium )
A l'équivalence, la quantité de matière d'ion hydroxyde est égale à la quantité de matière de chlorure d'ammonium.
n = 1,00 10-2 x 11,5 = 0,115 mmol dans 40 mL de S0, soit 0,115 x250 / 40 ~ 0,72 mmol dans 1 g de bonbon.
Masse de chlorure d'ammonium dans 1 g de bonbon : 0,115 x M( NH4Cl) = 0,72 x 53,5 = 38,5 mg.
Pourcentage massique de chlorure d'ammonium : 0,0385 x100 / 1 ~3,9 %.
3.3. Mise à part
l’erreur sur la détermination du volume équivalent, indiquer une des
autres sources possibles d’erreur sur la détermination du pourcentage
massique en chlorure d’ammonium dans le bonbon.
La solution d'hydroxyde de sodium a été préparée depuis un certain temps et se trouve carbonatée.
Erreur sur la pesée des bonbons.
|
|