Les
caractéristiques d'un sol truffier,
Bac S Liban 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
Les
truffières sont souvent implantées dans d'anciennes vignes qui ont reçu
d'importantes quantités de cuivre sous forme de bouillie bordelaise. Un
sol n'est pas propice aux truffes au delà de 100 mg d'ions cuivre par
kilogramme de sol.
Un sol truffier est calcaire, riche en carbonate de calcium. Le pourcentage massique en CaCO3 (s) doit être compris entre 20 et 60 %.
Le pH d'un sol truffier doit être compris entre 7,5 et 8,5.
1. Le pH du sol.
Le dioxyde de carbone de l'atmosphèe se dissout dans l'eau. On observe au niveau du sol la réaction suivante :
CaCO3(s) + CO2, H2O ---> Ca2+aq + 2HCO3-aq. (1).
On introduit un échantillon de sol à analyser dans de l'eau distillée.
Après agitation on laisse reposer et on filtre. La concentration
molaire en ion oxonium de la solution obtenue est 1,25 10-8 mol / L.
1.1 Vérifier que les conditions de pH sont favorables à la culture des truffes.
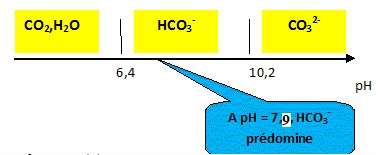
pH = - log(1,25 10-8)= 7,9.
Cette valeur étant comprise entre 7,5 et 8,5, la condition de pH est favorable à cette culture..
1.2. Identifier, sur un axe gradué en fonction du pH, les domaines de prédominances des espèces acido-basique : HCO3-aq, CO32-aq et CO2, H2O.
Quelle espèce prédomine dans la solution aqueuse de sol préparée ? Justifier.
1.3. Ecrire l'équation de la réaction acidi-basique entre le dioxyde de carbone dissous et l'eau.
CO2, H2O +H2O= HCO3-aq +H3O+aq.
1.4. Comment évoluerait le pH du sol si la quantité de dioxyde de carbone dissous venait à augmenter ?
L'équilibre précédent sera déplacé dans le sens direct, consommation de dioxyde de carbone dissous, formation d'ion HCO3-aq et d'ion H3O+aq.
La concentration en ion H3O+aq augmente et le pH du sol diminue.
|
|
|
|
|
2. La teneur en calcaire du sol.
En versant un peu d'acide chlorhydrique concentré sur le sol calcaire, on observe une effervescence.
CaCO3(s) + 2H3O+aq ---> Ca2+aq + CO2(g) +3 H2O(l)
On peut utiliser cette réaction pour déterminer la teneur en carbonate de calcium d'un sol.
On recueille V = 72 mL de dioxyde de carbone pour un échantillon de masse m = 1,2 g de sol. Vmolaire = 24 L / mol.
2.1. Expliquer pourquoi l'acide chlorhydrique doit être en excès.
On doit être certain que tout le carbonate de calcium contenu dans le sol va réagir.
2.2. La quantité de calcaire contenu dans le sol étudié convient-elle à la culture de la truffe ?
Quantité de matière de CO2 : n =0,072 / 24 = 0,003 mol.
Quantité de matière de CaCO3 : 0,003 mol.
Masse molaire du carbonate de calcium : 100,1 g/mol.
Masse de carbonate de calcium dans 1,2 g de sol :
100,1 x0,003 = 0,30 g soit 0,30 x100 / 1,2 = 25 %.
Le pourcentage massique en CaCO3 (s) d'un sol truffier doit être compris entre 20 et 60 %.
Ce sol convient à cette culture.
3. La teneur en cuivre du sol.
On prépare 1,00 L d'une solution aqueuse avec une masse m = 500,0 g de
sol à analyser. Après agitation, traitement et filtration, les ions
cuivre Cu2+aq de la solution sont dosés par spectrophotométrie.
Une série de solutions aqueuses de sulfate de cuivre de volume V = 50,0 mL est préparée à partir d'une solution mère S0 de concentration molaire apportée en soluté c0 = 1,0 10-2 mol/L = 10 mmol / L.
On mesure l'absorbance de ces solutions pour une longueur d'onde du maximum d'absorption dans l'eau de l'ion Cu2+aq : lmax = 800 nm.
On mesure l'absorbance AS de la solution de sol : AS = 0,035.
Solution
|
S1
|
S2
|
S3
|
S4
|
S5
|
Concentratio en sulfate de cuivre ( mmol / L)
|
1,0
|
2,0
|
5,0
|
8,0
|
10
|
Absorbance A
|
0,010
|
0,019
|
0,045
|
0,082
|
0,103
|
3.1 Proposer une liste de matériel et un protocole pour préparer la solution S3 à partir de S0.
Facteur de dilution : F = 10 / 5,0 = 2.
Fiole jaugée de 50,0 mL ; pipette jaugée de 25,0 mL.
Prélever 25,0 mL de solution mère, placer dans la fiole jaugée.
Compléter avec de l'eau distillée jusqu'au trait de jauge, boucher et agiter pour rendre homogène.
|
|
3.2. Déterminer la concentration molaire en ion cuivre (II) de la solution de sol préparée.
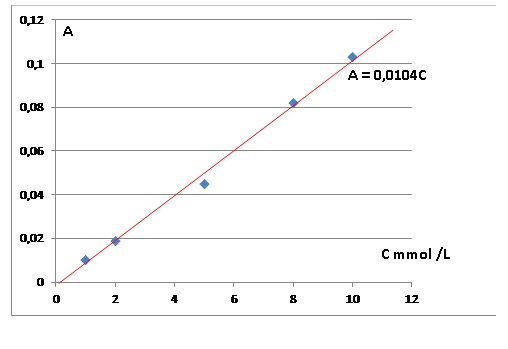
C = 0,035 / 0,0104 = 3,37 mmol /L.
3.3. En déduire la concentration massique en ion cuivre (II) du sol.
M(Cu2+aq) = 63,5 g / mol.
3,37 x 63,5 = 213,7 mg / L ~0,21 g / L soit 0,21 g d'ion cuivre (II) dans m = 500 g de sol.
0,42 g d'ion cuivre (II) par kilogramme de sol.
Un
sol n'est pas propice aux truffes au delà de 100 mg d'ions cuivre par
kilogramme de sol.
4. Le sol est-il propice à la culture de la truffe ?
Les conditions de pH et de carbonate de calcium sont favorables. Mais le sol contient trop d'ion cuivre (II).
Ce sol n'est pas propice à cette culture.
|
|