L'univers
aurait un goût de framboise et un coeur de rhum, Bac S Centres
étrangers 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
(function(){var
e=document.createElement("script"),f=document.getElementsByTagName("script")[0];e.src="//player.pepsia.com/sdk.js?d="+(new
Date).getTime
.
|
|
Un
radiotélescope braqué sur le centre de notre galaxie montre la présence
d'une cinquantaine de molécules organiques différentes.
Les trois principales sont : l'aminoacétonitrile NH2CH2CN , le méthanoate d'éthyle HCOOC2H5 et le butanenitrile C3H7CN.
1. Synthèse du méthanoate d'éthyle.
Il peut être synthétisé par réaction entre l'acide méthanoïque et l'éthanol en présence de quelques gouttes d'acide sulfurique.
1.1. Indiquer à quelle famille chimique appartient le méthanoate d'éthyle. Justifier.
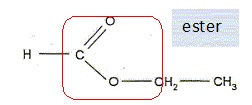
1.2 Préciser le rôle de l'acide sulfurique ainsi que son influence sur la réaction.
L'acide sulfurique est un catalyseur: il accélère la réaction.
L'équilibre est plus rapidement atteint, mais sa composition n'est pas
modifiée.
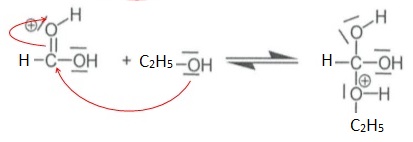
1.3. L'une des étapes de la synthèse est représentée ci-dessous.
Après avoir identifier le site donneur et le site accepteur mis en jeu,
représenter les flèches courbes rendant compte de cette étape.
Le site donneur est l'oxygène de l'éthanol.
Le site accepteur est le carbone de l'acide méthanoïque.
|
|
|
|
|
2. Calcul du rendement.
On
introduit dans le mélange initial 2,3 g d'acide méthanoïque et 2,8 g
d'éthanol. Déterminer le rendement de la synthèse si l'on obtient 1,9 g
de méthanoate d'éthyle.
Quantité de matière :
éthanol : m / M(éthanol) = 2,8 / (2x12+16+6) = 2,8 / 46 = 0,0608 mol.
acide méthanoïque : 2,3 / M( HCOOH) = 2,3 / 46=0,050 mol ( en défaut).
On peut espérer au mieux obtenir 0,050 mol d'ester en cas de réaction totale.
Masse théorique d'ester 0,05 M(ester) = 0,050 x74 =3,7 g.
Rendement : masse réelle / masse théorique x100 = 1,9 / 3,7 x100 = 51 %.
|
|
3. Analyse spectrale.
3.1. Une analyse du méthanoate d'éthyle donne le spectre IR suivant. Identifier les liaisons correspondant à :
Massif à 3000 cm-1 : liaison C-H.
Pic étroit et intense vers 1700 cm-1 : liaison C=O.
Pic étroit et fort vers 1200 cm-1 : C-O.
3.2.
Combien de signaux sont présents dans le spectre RMN du proton du
méthanoate d'éthylz ? Préciser en justifiant leur multiplicité..
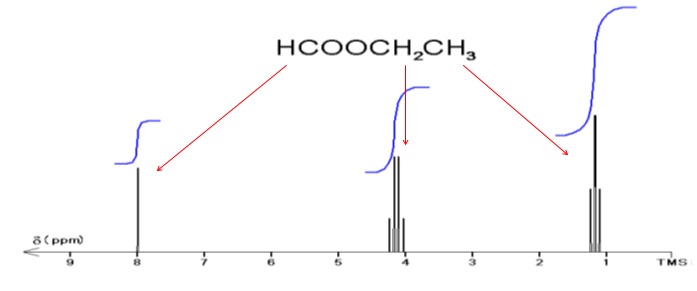
Le proton HCOO CH2-CH3 : le carbone voisin ne porte aucun proton, donc singulet.
Les protons HCOO CH2-CH3 : le carbone voisin porte trois protons, donc quadruplet.
Les protons HCOO CH2-CH3 : le carbone voisin porte deux protons, donc triplet.
|
|