L'acide
citrique au quotidien, Bac S Asie 2018
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
1. Propriétés acido-basiques.
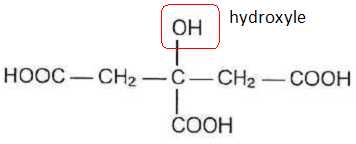 1.1. Rappeler ce qu'est un acide selon Brönsted. Expliquer pourquoi l'acide citrique est qualifié de triacide.
1.1. Rappeler ce qu'est un acide selon Brönsted. Expliquer pourquoi l'acide citrique est qualifié de triacide.
Un acide est une espèce, ion ou molécule, susceptible de céder un proton H+.
L'acide citrique compte trois groupes carboxyle, d'où le qualificatif de triacide.
1.2 Parmi
les quatre molécules suivantes, indiquer celle qui prédomine an milieu
très acide et celle qui prédomine en milieu très basique. Justifier.
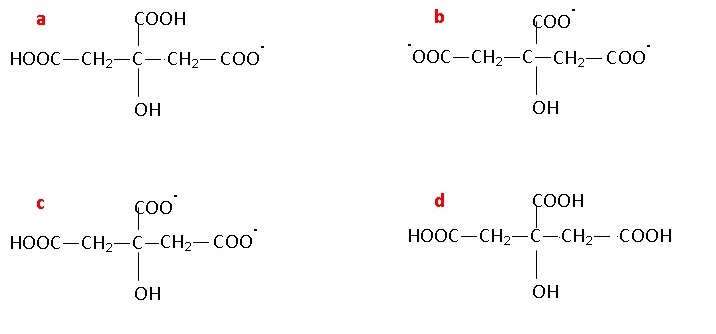
En milieu très acide, les trois groupes carboxyles sont sous la forme COOH. (d).
En milieu très basique, les trois groupes carboxyles sont sous la forme COO-. (b).
1.3. Associer chaque espèce acido-basique a, b, c, d à une courbe 1, 2, 3 ou 4 du diagramme de distribution..
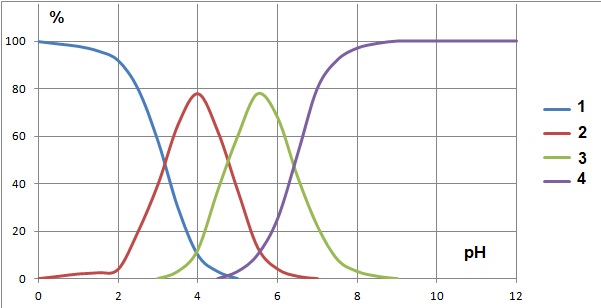
1 est associée à d ; 4 est associée à b ; 2 est associée à a ; 3 est associée à c.
1.4. Le pH d'une
solution aqueuse d'acide citrique de concentration 15 mmol / L est
environ 2;5. Quelles sont les formes prédominante de l'acide
citrique dans cette solution ? Estimer leur proportionns
relatives.
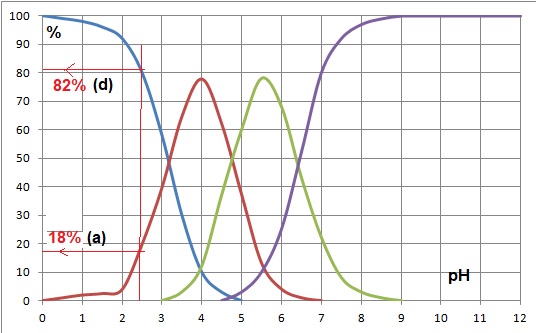
.
|
|
...
|
|
1.5. Indiquer à quelle grandeur acido-basique particulière correspond la valeur de pH égale à 3,2. Justifier.
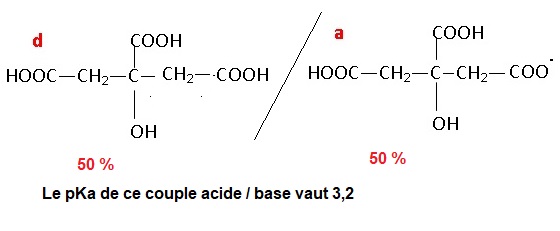
1.6. L'acide citrique possède t-il un atome de carbone asymétrique. Justifier.
Non, aucun atome de carbone tétragonal ne possède quatre substituants différents.
|
|
2. Extraction de l'acide citrique d'un citron.
1. Extraire le jus d'un citron, puis le filtrer pour enlever la pulpe.
2. Ajuster le pH à environ 9 en ajoutant une solution aqueuse d'ammoniac concentrée.
3. Ajouter une solution aquueuse de chlorure de calcium, on observe la formation d'un précipité de citrate de calcium.
4. Filtrer sous vide pour récupérer le solide formé.
5. Amener le pH à 1 en ajoutant une solution aqueuse d'acide
sulfurique. Après agitation lente, on obtient une solution laiteuse.
6. Filtrer à nouveau cette solution, puis placer le filtrat dans une
ampoule à décanter. Ajouter un peu d'éthanoate d'éthyle dans l'ampoule,
puis après agitation et décantation, jeter la phase aqueuse et
récupérer la phase organique.
7. L'acide citrique est isolé à l'aide d'un évaporateur rotatif qui va
évaporer le solvant organique. On réalise le spectre infra-rouge du
produit extrait.
2.1.
L'acide citrique se trouve sous la forme b ( ion citrate) à la
fin de l'étape 2 du protocole. Ecrire la formule brute de cet ion. En
déduire la formule brute du précipité de citrate de calcium formé à la
fin de l'étape 3.
ion citrate : C6H5O73- ; citrate de calcium Ca3(C6H5O7)2.
2.2. Expliquer pourquoi le précipité de citrate de calcium disparaît au cours de l'étape 5.
A
pH = 1, c'est la forme d de l'acide citrique qui prédomine. Cette forme
de possède pas de charge électique négative. Les ions calcium ne
subissant plus d'attraction électrique de cette forme d, le solide
ionique disparaît.
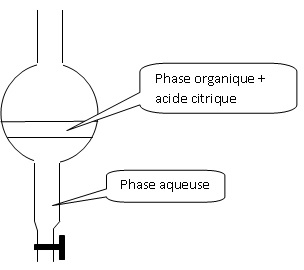
2.3. Faire un schéma légendé de l'ampoule à décanter utilisée lors de l'étape 6.
La phase la plus dense ( eau d = 1,0) occupe la partie
inférieure. La phase organique ( éthanoate d'éthyle d = 0,92), la moins
dense, occupe la partie supérieure.
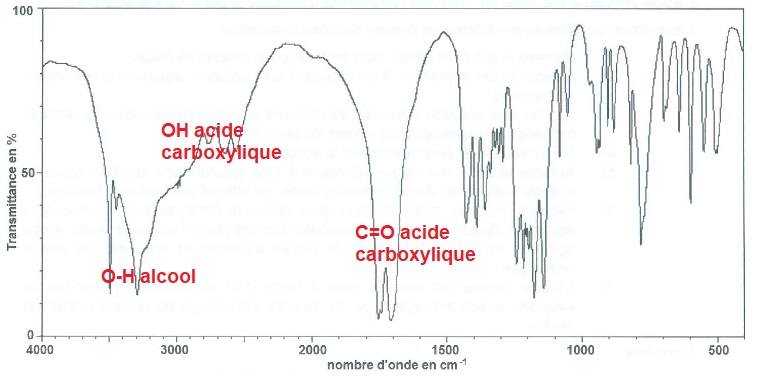
2.4. Le spectre
isolé après évaporation du solvant organique est représenté ci-dessous.
Ce spectre confirme-t-il que le produit extrait du citron par ce
protocole est de l'acide citrique ?
Ce spectre est cohérent avec celui de l'acide citrique.
3. Analyse d'un détartrant à l'acide citrique.
Un laboratoire met en place un protocole afin de déterminer :
- la forme anhydre ou monohydratée de l'acide citrique présente dans un détartrant commercial en poudre.
-La pureté de l'acide citrique dans ce détartrant.
Protocole utilisé :
Poser une coupelle sur le plateau d'une balance et appuyer sur Tare.
Mettre un peu de détartrant dans la coupelle, la balance indique alors 0,053 g.
Introduire le contenu de la coupelle dans un bécher, ajouté un peu
d'eau distilée puis agiter pour dissoudre totalement le solide.
Mettre le becher sous une burette graduée remplie avec une solution d'hydroxyde de sodium de concentration C = 5,00 10-2 mol / L.
Placer une électrode de pH-métrie dans le becher et la relier au pHmètre.
Sous agitation magnétique, ajouter progressivement la solution aqueuse
d'hydroxyde de sodium en relevant régulièrement le pH de la solution.
Equation de la réaction support du titrage :
C6H8O7 aq + 3HO-aq ---> C6H5O7 3- aq +3H2O(l).
3.1. Expliquer pourquoi le coefficient stoechiométriique dans cette équation vaut 3 pour les ions hydroxyde.
L'acide citrique est un triacide.
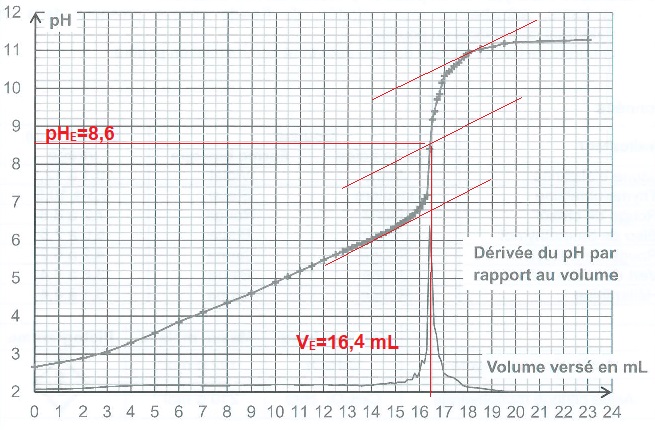
3.2. En expliquant votre démarche, déterminer la valeur VE du volume de solution d'hydroxyde de sodium versé à l'équivalence.
Méthode des tangentes ou utilisation de la courbe dérivée.
3.3. Quel
indicateur coloré pourrait-on utiliser pour réaliser ce titrage sans
pH-mètre ? Préciser comment serait repéré le volume équivalent.
La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent ( 8,6 dans ce cas).
Le rouge de crésol convient. ( zone de virage 7,2 à 8,8).
Avant l'équivalence, la solution du becher est jaune ; après l'équivalence elle est rouge.
3.4. En exploitant ces résultats :
Montrer que le détartrant ne peut pas être de l'acide citrique monohydraté.
Déterminer le pourcentage massique d'acide citrique anhydre du détartrant.
Conclure sur la pureté du détartrant.
Quantité de matière d'ion hydroxyde versé à l'équivalence : 16,4 x5,00 10-2 =0,82 mmol.
Quantité de matière d'acide citrique : 0,82 / 3 =0,273 mmol.
Masse molaire de l'acide citrique monohydraté : 210 g/mol.
Masse d'acide citrique monohydraté : 210 x 0,273 ~57,4 mg.
Cette valeur étant supérieure à l'indication de la balance, il ne s'agit pas d'acide citrique monohydraté.
Masse molaire de l'acide citrique anhydre : 192 g/mol.
Masse d'acide citrique anhydre : 192 x 0,273 ~52,5 mg.
Pureté : 52,5 / 53 x 100 = 99 %. Le détartrant est pur.
|
|