QCM, unités,
sécurité, thermodynamique, dosage.
Concours ITRF Versailles 2016 .
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Exercice
1. QCM. 12 points ; 1 point par réponse juste ; -0,25 point par
réponse fausse.
1. Les limites de longueurs d’onde
dans le domaine du visible sont approximativement :
40 - 80 nm ; 400 - 800 nm ;
400 - 800 µm.
2. Laquelle de ces molécules représente-t-elle un alcène ?
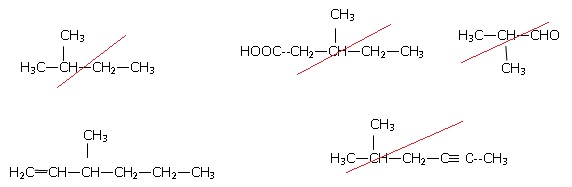
3. Nommer
l’alcène repéré à la question précédente :
3-méthylhex-1-ène ;
3,3-méthylpropylprop-1-ène ; 3,5-diméthylpent-1-ène ;Térylène.
4.
Deux séances de TP se déroulent à trois semaines d'intervalle. Vous
préparez une quantité suffisante de solution d'hydroxyde de sodium à
0,100 mol/L pour les deux séances et vous prévoyez une bouteille de
vinaigre blanc à 8°. Les résultats obtenus différent entre les deux
séances.
Cochez l’explication correcte.
- Le degré d'acidité du vinaigre blanc a augmenté.
- Le degré d'acidité du vinaigre blanc a diminué.
-La solution titrante est carbonatée : son pH a augmenté. Vrai.
- La solution titrante est carbonatée : son pH a diminué .
5. Que signifie
l’acronyme EPI :
- Etablissement de Priorité Intermédiaire
- Equipement de Protection Individuel. Vrai.
- Enseignements Pratiques Interdisciplinaires
- Equipes Pédagogiques Intercatégorielles
- Equations Périodiques Imaginaires.
6.
A quels éléments correspondent les symboles suivants :
B : Bismuth ; Béryllium ; Bore ; Bismuth.
Mn : Mercure ; Manganèse
; Magnésium ; Molybdène
Po : Potassium ; Platine ; Phosphore ; Polonium
As: Arsenic ;
Astate ; Argent ; Osmium.
7. Une molécule est dite chirale si :
- Elle se superpose à son image dans un miroir
- Elle possède deux carbones asymétriques
- Elle ne comporte pas de carbone asymétrique
- Elle ne peut pas se superposer à son image dans un miroir. Vrai.
8. Quelle est l’unité d’une capacité
:
Le Henry ; Le Farad ; Le
Coulomb ; La dioptrie ; Le Joule.
9. Dans la liste ci-dessous quels
éléments appartiennent à la famille des halogènes (plusieurs réponses
sont attendues) :
Astate ; Fluor ; Béryllium ; Iode ; Néon ; Chlore.
10.
Un noyau de carbone 146C contient (plusieurs
réponses sont attendues):
6 protons ; 6 neutrons ;
8 protons ; 8 neutrons ; 8
électrons.
11. L’activité d’un
échantillon radioactif (plusieurs réponses sont attendues) :
- Est la masse des noyaux radioactifs que contient un échantillon.
- Est le nombre moyen de désintégrations par unité de temps que
subissent les noyaux radioactifs d’un échantillon. Vrai.
- Décroît au cours du temps. Vrai.
- Ne varie pas au cours du temps : C’est une caractéristique du type de
noyau radioactif que contient l’échantillon.
12. Pour réaliser
le spectre de la lumière blanche, à la place du prisme on peut utiliser
:
- Un miroir ; Un réseau
; Une lentille ; Un condenseur.
|
|
|
Exercice 2: Unités, grandeurs et
conversions (15 points.
1. Préfixes
multiplicateurs ou diviseurs des unités
Compléter le tableau suivant.
Nom
|
Méga
|
nano
|
micro
|
Giga
|
milli
|
pico
|
Puissance
de 10
|
106
|
10-9 |
10-6
|
109
|
10-3
|
10-12
|
Symbole
|
M
|
n
|
µ
|
G
|
m
|
p
|
2. Grandeurs
et unités SI. Remplir le tableau suivant.
Grandeur
|
Masse
|
Tension
|
Intensité
|
Pression
|
Température
|
Résistance
|
Energie
|
Puissance
|
Unité
( SI)
|
kg
|
V
|
A
|
Pa
|
K
|
W
|
J
|
W
|
3. Unités et conversions
Convertir les données suivantes dans l’unité demandée, en exprimant le
résultat en notation scientifique
a. 50 µL = 5 10-8.m3
b. 2000 cm-1 =2 105.m-1
c. 3 GPa =3 109 Pa =3 107 hPa=3 107
mbar
d. 5 MHz = 5 106 Hz = 106 s-1
e. 4,2 K =4,2-273= -268,8°C
f. r(cyclohexane)
= 779 kg.m-3 =0,779 g.mL-1.
4.
Densités et masses volumiques
a. Définir la
densité d’un gaz.
Masse d'un certain volume de gaz divisé par la masse du même volume
d'air mesuré dans les mêmes conditions de température et de pression.
b. Si M est la
masse molaire du gaz, montrer que sa densité peut être calculée par d =
M / 29 dans les CNTP. Masses molaires (g.mol-1) : N = 14,0
et O = 16,0.
Masse molaire de l'air : 0,2 x32 +0,8 x28 ~29 g/mol.
densité = masse molaire du gaz / masse molaire de l'air = M / 29.
c. Quelle est la
densité du dichlore (masse molaire de Cl = 35,45 g.mol-1) ?
d = 2 x35,5 / 29 ~2,4.
|
|
|
|
Exercice 3. Hygiène et sécurité.
Partie 1 :
1. Que signifient
ces pictogrammes :

2.
Les formes et les couleurs des panneaux pour la signalisation de santé
et de sécurité varient en fonction de leur signification.
Indiquer leur forme et couleur dans le tableau suivant :
Signification
|
Interdiction
|
Avertissement
|
Obligation |
Evacuation
|
Forme
|
Circulaire
|
Triangulaire
|
Circulaire
|
Carré
|
Couleur
|
Rouge
sur fond blanc
|
Fond
jaune, bordure noire
|
Bleu
|
Vert
|
3. Les lasers sont classés en
4 classes. Jusqu’à quelle classe peut-on utiliser un laser sans
protection oculaire ?
Classe 1 et classe 2.
4. Un disjoncteur
a sauté dans le tableau électrique de la salle de Travaux Pratiques. Le
professeur ne peut plus manipuler car il n’y a plus de courant aux
paillasses des élèves.
- J’appelle un Ouvrier Professionnel électricien. Vrai.
- J’ouvre le tableau électrique et réarme le disjoncteur.
- Je ne fais rien.
5. . Placer les
symboles suivants dans le tableau ci-dessous rappelant la classe des
appareils électriques :
Classe
|
Description
|
Symbole
|
0
|
Isolation
simple. Interdit en Europe
|
aucun
|
1
|
Les
parties métalliqueq accessibles
sont reliées à la terre
|
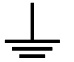
|
2
|
Double
protection : aucune partie métallique n'est accessible ;
les appareils n'ont pas besoin d'^tre reliés à la terre.
|

|
3
|
Appareils
très basse tension de sécurité alimenté en 50 V maxi.
|
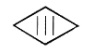
|
6. Les affirmations
suivantes sont-elles vraies ou fausses ?
a. Je n’ai pas
besoin d’une habilitation électrique pour réarmer un disjoncteur dans
le tableau électrique de ma salle de T.P. Faux.
b. J’ai une
habilitation électrique B0, je peux réarmer un disjoncteur dans le
tableau électrique de ma salle de T.P. Faux.
c. L’électrisation
est un accident mortel. Faux.
d. Un court-circuit
peut provoquer un dégagement de gaz toxiques. Vrai.
e. La présence d’un
disjoncteur différentiel dans un tableau électrique assure la sécurité
des personnes. Vrai.
7.
Que veulent dire les acronymes suivants :
TBT : très basse tension ; BT ; basse tension ; HT : haute tension.
Partie 2 :
1. Vous disposez de
trois boites de gants de matières différentes (PVC aussi appelé vinyle,
nitrile et polyéthylène).
Indiquer dans le tableau suivant les gants que vous pouvez proposer au
cours d’un enseignement de travaux pratiques en fonction des produits
manipulés.
|
PVC
ou vinyle
|
nitrile
|
Polyéthylène
|
|
Solution
aqueuse CuSO4
|
X
|
X
|
X
|
|
Hexane
|
|
X
|
|
|
Acide
chlorhydrique
|
X
|
X
|
|
|
Solution
de soude
|
X
|
X
|
|
|
Acétone
|
|
|
|
|
Ethanol
|
X
|
X
|
|
|
Acétate
d'éthyle
|
|
|
|
|
Toluène
|
|
X
|
|
|
Ether
diéthylique
|
|
X
|
|
|
Nitrile :
éviter les carbonyle et amine.
PVC : bonne résistance chimique aux acide et base, éviter les composés
organiques.
Thermodynamique 10 points.
Partie 1 : calorimétrie.
On souhaite déterminer la capacité en eau d’un calorimètre. Pour ce
faire, nous munissons un calorimètre d’une sonde de température et d’un
système d’agitation. On introduit dans ce calorimètre 75 g d’eau, après
un certain temps la température de l’ensemble « calorimètre + eau » se
stabilise à 19°C. On rajoute alors 75 g d’eau chaude (initialement à
90°C) dans le calorimètre et la température se stabilise à 48°C.
Donnée : capacité thermique massique eau : 4180 J.kg-1.K-1.
1. Déterminer la
capacité thermique massique du calorimètre.
Energie gagnée par le calorimètre et l'eau froide : Q1 =
(0,075 x4180 +µ) (48-19) = 9091,5 +29 µ.
Energie cédée par l'eau chaude : Q2 = 0,075 x4180 (48-90)=
-13167 J.
Système adiabatique ; 9091,5 +29 µ -13167=0 d'où µ =140,5 J K-1.
2. Déduire de la
question précédente l’équivalent en eau du calorimètre utilisé.
140,5 / 4180 = 0,0336 kg = 33,6 g.
Partie 2 : étude d’un gaz.
Une masse de gaz est considérée dans 3 états successifs :
Etat 1 : P1 V1 T1 Données : P1
= 1.105 Pa. V1 = 2,0 L. T1 = 27 °C
Etat 2 : P2
V2 T2 . Etat 3 : P3 V3 T3
1. Le passage de
l’état 1 à 2 se fait à pression constante, avec une élévation de
température de 20 K.
Déterminer P2 V2 T2.
P2=P1 = 105 Pa. T2 = T1
+20 = 47°C.
Dans l'hypothèse d'un gaz parfait : V2 / T2
= V1 / T1 =nR / P1 ;
V2 = 2,0 x(273+47) / (273+27 )=2,13 L.
2. Le passage de
l’état 2 à 3 se fait à température constante, avec une élévation de
pression de 1.104 Pa.
Déterminer P3 V3 T3.
P3 =105 +104 = 1,1 105 Pa. T3
= T2 = 320 K.
P2V2 = P3V3 ; V3
= 105 x2,13 / (1,1 105)=1,94 L.
.
|
Exercice 5 : dosage.
Pour les besoins d’une
séance de travaux pratiques, il est nécessaire de disposer d’environ 1
litre d’une solution 0,150 mol.L-1 d’acide chlorhydrique (notée solution A).
Pour cela, on dispose d’un flacon portant les indications suivantes :
Acide chlorhydrique
37% ; 1,18 kg/L ; MM 36,46.
1. Quelle est la concentration
approximative de la solution mère d’acide chlorhydrique ?
Masse de un litre : 1,18
kg ; masse d'acide dans 1 L : 1,18 x0,37 =0,4366 kg = 436,6g.
Quantité de matière
d'acide dans 1 L = concentration = 436,6 / 36,46 ~11,97 ~12 mol / L.
2. Expliquer les différentes
étapes que vous suivrez pour préparer 1 litre de la solution désirée
(solution A) en citant le matériel utilisé. On donnera en particulier
le volume de solution mère prélevé (ou la masse)
Facteur de dilution F = 11,97 / 0,150 =79,83
A laide d'une burette ( ou d'une pipette )graduée, prélever 1000 /
79,83 = 12,5 mL de la solution mère.
Placer ce prélèvement dans une fiole jaugée de 1,00 L contenant un
tiers d'eau distillée.
Compléter avec de l'eau distillée jusqu'au trait de jauge. Boucher et
agiter pour rendre homogène.
3. Pour vérifier le
titre de la solution A, on dispose d’une solution d’hydroxyde de sodium
de concentration connue à 0,100 mol.L-1.
a. Représenter un
schéma légendé du montage permettant de réaliser le dosage.
..........
b. Ecrire
l’équation du dosage de la solution A par l’hydroxyde de sodium.
H3O+ aq +HO-aq --> 2H2O.
c. Pour effectuer
le dosage, un volume de 15 mL de la solution A est utilisé auquel on
ajoute 35 mL d’eau environ. Ce dosage est effectué plusieurs fois et le
volume moyen obtenu à l’équivalence est de 22,40 mL. Calculer la
concentration de la solution A.
Ca = cB Véq / Va = 0,100
x22,40 / 15 = 0,149 mol / L.
d. L’incertitude
calculée associée à la concentration de la solution A est de 7,8.10-4
M.
Quelle indication devrez-vous indiquer sur le flacon de la solution A
(concentration ± incertitude) ?
0,149 ±8 10-4 M.
4. Selon vous, les
courbes suivantes, qui représentent le pH en fonction du volume de
solution titrante versé, peuvent être obtenues au cours de quel type de
dosage ? (plusieurs réponses possibles)
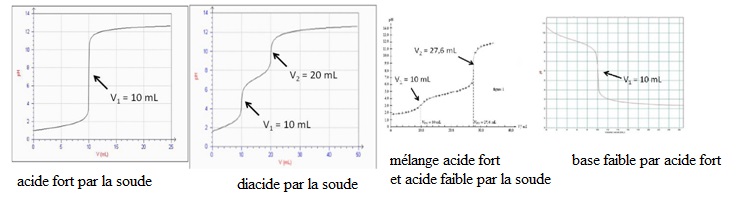
|
|