Utilisation de
prodrogues.
Concours général 2017.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Une
prodrogue est une espèce chimique composée du principe actif
chimiquement lié à un groupe
transporteur qui peut être retiré par transformation chimique in vivo,
avec ou sans enzyme. De nombreux objectifs peuvent être visés lors de
la conception de prodrogues : augmentation de l’adsorption ou de
laspécificité d’action, suppression de caractères organoleptiques
indésirables (goût, odeur), etc.
C1. Prodrogue améliorant la lipophilie d’un principe actif
L’ampicilline est un antibiotique à large spectre d’action mais seul 40 % de la dose administrée est
absorbée par l’organisme.
39. Recopier la
formule de la molécule. Identifier les atomes de carbone asymétriques
présents et en déduire le nombre de stéréoisomères de configuration.
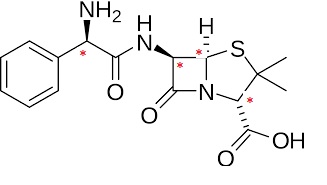
Théoriquement 24 = 16 stéréoisomères de configuration. La présence des cycles à 4 et 5 atomes fait qu'il y en aura moins.
40. Sur la représentation précédente, entourer les groupes caractéristiques et nommer les fonctions chimiques correspondantes.
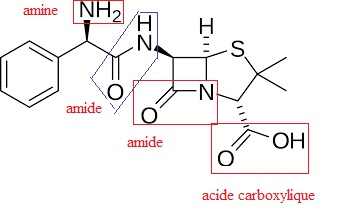
Afin d’améliorer l’absorption du principe actif, on améliore la
lipophilie de la molécule d’ampicilline en la transformant en prodrogue
sous forme de molécule de pivampiciline représentée ci-dessous. Son
taux d’adsorption devient alors égal à 98 %. Une fois libérée dans le
sang, la pivampicilline se transforme totalement en ampicilline par
hydrolyse sous l’action d’une enzyme.
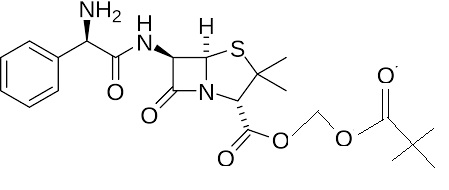
41. Justifier l’évolution de la lipophilie lors de la transformation de l’ampicilline en pivampicilline.
Le remplacement de la fonction acide carboxylique par la fonction ester rend la molécule moins polaire.
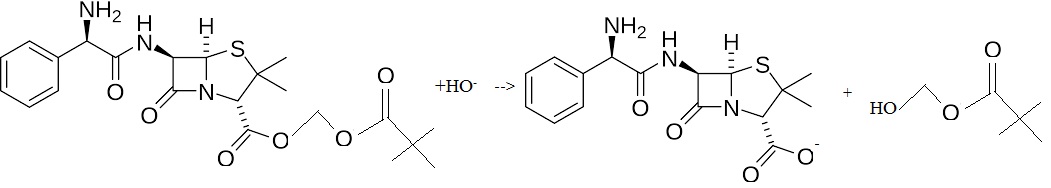
42. Ecrire l’équation de la réaction de transformation enzymatique de la pivampililline en ampicilline dans le sang et donner sa nature.
Le sang est un milieu légérement basique ( pH ~7,4). Il s'agit d'une hydrolyse basique, réaction totale.
43. Sachant que l’ampicilline est prescrite à une dose de 2,0 g par jour, calculer la dose quotidienne quand le traitement est prescrit sous forme de pivampicilline.
M(ampiciline) =349,4 g/mol ; M(pivampiciline) = 463,5 g/mol.
2,0 / 349,4 x 463,5 = 2,653 ~2,7 g.
C2. Prodrogue facilitant la traversée de la barrière hémato-encéphalique
La L-DOPA est un médicament utilisé dans le traitement de la maladie de
Parkinson. En effet cet acide α aminé peut, lié à un transporteur actif
(LAT-1), traverser la barrière hémato-encéphalique, paroi composée
d’une bicouche lipidique et séparant le sang du système nerveux au
niveau du cerveau
(SNC). Une fois la barrière franchie, cette prodrogue est alors
métabolisée ; la L-DOPA est libérée, puis transformée en dopamine,
molécule qui atténue les symptômes de la maladie de Parkinson.
44. Quelle bande en spectroscopie infrarouge permet de différencier la L-dopa de la dopamine ?
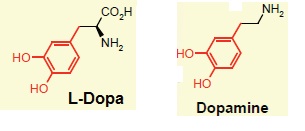
La L-Dopa présente une bande forte et fine vers 1740 cm-1 due au groupe C=O. Cette bande disparaît dans la dopamine.
|
|
|
La synthèse industrielle de la L-dopa est donnée ci-dessous. Elle s’effectue à partir de la vanilline, abondante et bon marché.
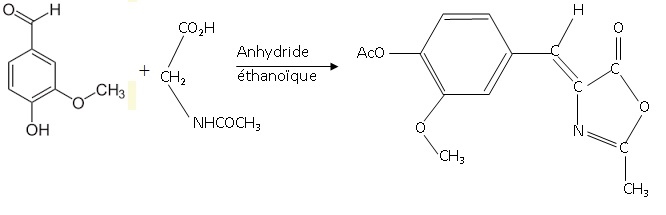
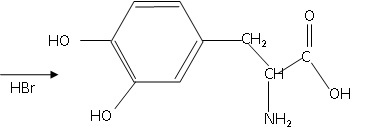
Notations :
Ac : acétyl, groupement –COCH3
Ac-O-Ac : anhydride éthanoïque
45. Il est signalé
dans la description de la synthèse de la L-Dopa que la vanilline
utilisée est abondante et bon marché. Indiquer si la vanilline utilisée
est d’origine naturelle ou si elle est d’origine synthétique.
Argumenter.
La vanilline naturelle représente de 0,75 à 2 % de la gousse de
vanille. La gousse pesant 3 g, elle contient entre 20 et 60 mg de
vanilline. Elle est peu abondante et coûte très chère à produire.
La synthèse utilise la vanilline de synthèse.
46. Déterminer
le(s) produit(s) formés dans la première étape de la synthèse, autre
que celui donné dans le schéma de synthèse, l’anhydride intervenant
aussi comme réactif.
Eau et acide éthanoïque.
47. Analyser les réactions intervenant au niveau de la fonction phénol (-OH) de la vanilline au cours de la synthèse. Commenter.
Acylation du phénol totale avec un anhydride d'acide.
|
|
|
|
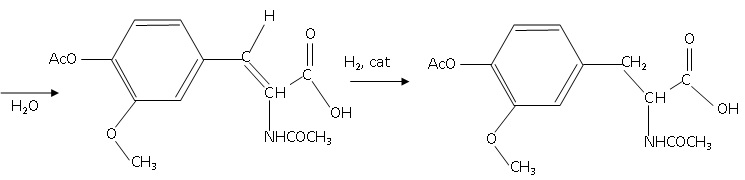
Le mécanisme de la réaction d’hydrolyse qui intervient au cours de la deuxième étape de la synthèse est
donné ci-dessous.
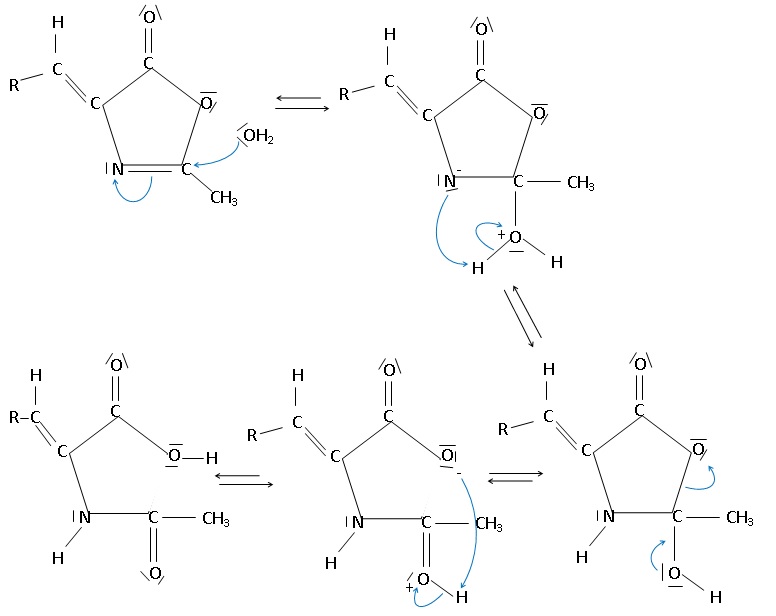
48. Caractériser les deux premières étapes du mécanisme à l’aide des termes : addition, élimination,
substitution, réaction acido-basique.
Addition de H2O sur la double liaison C=N.
49. Attribuer, en
justifiant, le caractère nucléophile ou électrophile aux deux sites
suivants : l’atome d’oxygène de la molécule d’eau et l’atome de carbone
de la double liaison C=N.
L'atome d'oxygène de la molécule d'eau porte deux doublets non liants ;
cet atome d'oxygène riche en électrons est un site nucléophile.
L'atome de carbone de la double liaison C=N est déficitaire en électron. Ce carbone est un site électrophile.
50. Une autre réaction d’hydrolyse pourrait être envisagée lors de la première étape de ce mécanisme.
Ecrire la formule semi-développée du produit qui aurait été alors obtenu
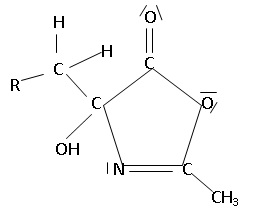
51. Expliquer pourquoi la réaction sur la double liaison C=N intervient au détriment de l’autre réaction envisageable.
Plus une liaison est polarisable, plus elle peut se rompre rapidement.
La double liaison C=N est polarisée alors que la double liaison C=C ne
l'est pas. De plus cette liaison C=C est conjuguée avec les liaisons
doubles du cycle benzénique.
|
|
|
|