Influence de
l'état de surface d'un matériau sur le frottement
Concours général 2017.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
II.A Expériences avec les métaux.
L'état de surface d'un matériau modifie ses propriétés vis à vis du frottement.
l'on a fait polir avec le plus grand soin deux règles de fer de 4 pieds
de longueur et de 2 pouces de largeur ; on les a fixées par leurs
extrémités au traîneau. l'on a fait faire quatre autres règles, deux de
fer et deux de cuivre jaune, de 15 pouces de longueur et de 18 lignes
de largeur....
Extrait, adapté des pages 85 et 86, de la Théorie des machines simples.
Lors
de l'étude du contact métal / métal, Coulomb réitère les mesures de la
partie I.A et obtient les résultats résumés dans le tableau suivant.
Naturedu contact
|
Masse du traîneau
chargé (livres)
|
Masse du plateau
chargé (livres)
|
µs |
fer / fer
|
53
|
15
|
15 / 53 ~0,28
|
fer / fer
|
453
|
125
|
125 / 453 ~0,28
|
fer / cuivre jaune
|
52
|
12,5
|
12,5 / 52 ~0,24
|
fer / cuivre jaune
|
452
|
110
|
110 / 452 ~0,24
|
Résultats
des mesures au seuil de glissement pour différents métaux. La masse du
plateau chargé est la masse minimale permettant de provoquer le
glissement
31. Estimer la
valeur du coefficient de frottement statique pour le contact fer / fer,
puis pour le contact fer / cuivre jaune. Commenter ces valeurs.
fer / fer ou fer /cuivre : µs est de l'ordre de 0,25, alors
que pour le contact chêne / chêne on avait environ 0,4. Il est plus
facile de faire glisser le traîneau sur un contact métal /métal que sur
le contact chêne / chêne.
II. B. Formation d'oxydes métalliques en surface.
Coulomb
avait fait polir les règles de fer pour éliminer la couche de rouille.
La rouille est un mélange complexe de produits solides d'oxydation du
fer.
La surface externe de pièces en fer ou en acier présente des
irrégularités à l'echelle microscopique, dues à des contraintes
mécaniques imposées lors de leur fabrication. A proximité de ces
irrégularités, le métal est plus facilement attaqué en milieu acide.
Dans ces zones, des atomes de fer se transforment en ion Fe2+aq
et libèrent des électrons, qui circulent dans le métal vers d'autre
zones où ils s'associent avec le dioxygène de l'air, ce qui conduit
notamment à la formation d'ion hydroxyde. Les ions Fe2+aq fréagissent à leur tour avec le dioxygène pour former un oxyde de fer.
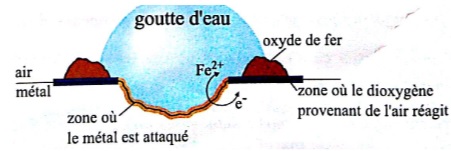
Extrait librement traduit et adapté de Chemistry, Zumdahl.
32. L'une des demi-équations électroniques intervenant dans le processus s'écrit :.
u O2(aq) +H2O(l) +v e- --> wHO-aq.
Identifier l'oxydant et déterminer les nombres u, v et w.
Le dioxygène est l'oxydant, il gagne des électrons et se réduit.
O2(aq) +2H2O(l) +4 e- --> 4HO-aq.
Le système modélisé ci-dessus ppeut être modélisé par une pile.
33. Justifier cette modélisation.
Le fer joue le rôle de cathode : il s'oxyde et libère des électrons.
Ces derniers circulent dans le métal vers d'autres zones ( anode ) où le dioxygène est réduit.
34. Donner l'équation de la réaction de fonctionnement de cette pile.
O2(aq) +2H2O(l) +4 e- --> 4HO-aq.
2Fe(s) -->2 Fe2+aq + 4e-.
Ajouter : O2(aq) +2H2O(l) +4 e- +2Fe(s)--> 4HO-aq +2 Fe2+aq + 4e-.
Simplifier : O2(aq) +2H2O(l) +2Fe(s)--> 4HO-aq +2 Fe2+aq.
II. C. Le cuivre jaune.
Le cuivre forme de nombreux alliages, dont les laitons, alliages cuivre
zinc. Ils contiennent en quantité moindre des métaux comme le plomb,
l'étain, le nickel. On peut déterminer le pourcentage d'étain d'un
laiton par gravimétrie, selon le procédé simplifié suivant.
En traitant un laiton par l'acide nitrique HNO3, l'étain qu'il contient est oxydé en acide métastannique H2SnO3
(s), composé non soluble dans ce milieu, alors que toutes les autres
espèces présentes le sont. Le solide est filtré, lavé et calciné sous
forme d'oxyde d'étain (IV) SnO2.
On réalise l'expérience sur trois échantillon en parallèle.
- Rincer le laiton avec de l'acétone pour éliminer toutes traces de graisses.
- Peser un échantillon 1 g à ±0,1 mg et le placer dans un becher de 250 mL couvert d'un verre de montre, sous hotte.
- Ajouter prudemment 5 mL d'acide nitrique à 3 mol / L, 25 mL d'eau distillée et chauffer sans faire bouillir pendant 45 min.
- Receuillir le solide humide H2SnO3 par filtration et le placer dans un creuset en porcelaine.
- Placer le creuset dans un four à 900°C jusqu'à ce que la masse du produit soit constante.
Une expérience a donné les résultats suivants : le traitement d'un
échantillon de masse 1024,6 mg de laiton a conduit à l'ontention de
14,3 mg d'oxyde d'étain sec SnO2.
35.
Proposer une explication à l'utilisation de l'acétone pour nettoyer
l'échantillon de métal en précisant le type d'interaction
intermoléculaires envisageables.
Les graisses sont constituées de longues chaînes carbonées
hydrophobes. L'acétone possède également une chaîne carbonée à 3 atomes
de carbone. Du fait de la présence d'un atome d'oxygène, l'acétone est
polaire.
Interactions moléculaires : forces de Van der Waals.
36. Avec quel type de verrerie mesure t-on les volumes de liquide utilisés dans ce protocole.
Des volumes peu précis sont mesurés avec une éprouvette graduée.
37.
Propooser un protocole expérimental de préparation de la solution
d'acide nitrique à 3 mol / L à partir d'une solution d'acide nitrique
concentrée.( 80 % en masse d'acide nitrique ; masse volumique à
20°C : 1,45 g cm-3).
L'acide nitrique est corrosif : port de blouse, gants et lunette de protection.
Masse de 1 L de solution concentrée :1,45 kg = 1450 g
Masse d'acide nitrique : 1450 x 0,80 = 1160 g.
Masse molaire HNO3 : M = 63 g/mol.
Concentration de la solution concentrée : 1160 / 63 ~18,4 mol/L.
Facteur de dilution F = 18,4 / 3 ~ 6,14.
Dans une fiole jaugée de 100 mL, contenant environ un tiers
d'eau distilée, verser à l'aide d'une pipette graduée, 100 / 6,14 ~16,3
mL de la solution concentrée. Compléter avec de l'eau distillée
jusqu'au trait de jauge. Boucher et agiter pour rendre homogène.
|
|
|
38. Proposer une équation de réaction traduisant l'action oxydante des ions nitrate NO3-
aq issus de l'acide nitrique sur l'étain solide Sn(s). On considèrera
que les ions nitrates sont trannsformés en dioxyde d'azote NO2(g).
4NO3- aq + Sn(s)+4H+aq --> H2SnO3(s) + 4NO2(g)+H2O(l).
39. La calcination permet à la fois le séchage du solide et sa déshydratation en SnO2. Interpréter cette double opération en terme de transformation physique et de transformation chimique.
Transformation physique : changement d'état physique de l'eau ( passage liquide à gaz).
Transformation chimique : déshydratation de H2SnO3(s).
H2SnO3(s) -->SnO2(s) + H2O(g).
40. Calculer le pourcentage massique d'étain présent dans ce laiton.
M(SnO2) = 118,7 +32= 150,7 g /mol.
Masse d'étain dans 14,3 mg d'oxyde d'étain (IV) : 14,3 x118,7 / 150,7 = 11,26 mg.
Pourcentage massique d'étain dans ce laiton : 11,26 / 1024,6 x100 ~ 1,1 %.
L'étain se trouve à l'état de traces dans ce laiton.
II.D. Utilisation d'une huile lubrifiante.
Si
la première stratégie pour modifier le coefficient de frottement
consiste à modifier l'état de surface en travaillant sur une éventuelle
couche d'oxyde, on peut aussi envisager d'enduire les surfaces en
contact d'une huile lubrifiante. L'huile étudiée est dérivée de la
molécule A dont le spectre infrarouge est fourni ci-dessous :
41. Analyser ce spectre infrarouge.
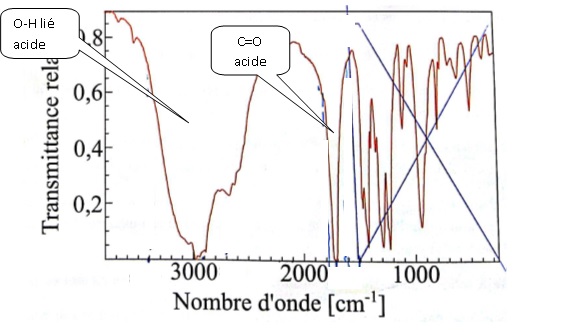 . .
42.43. Exploiter le spectre RMN fourni, proposer une formule topologique pour A et nommer A.
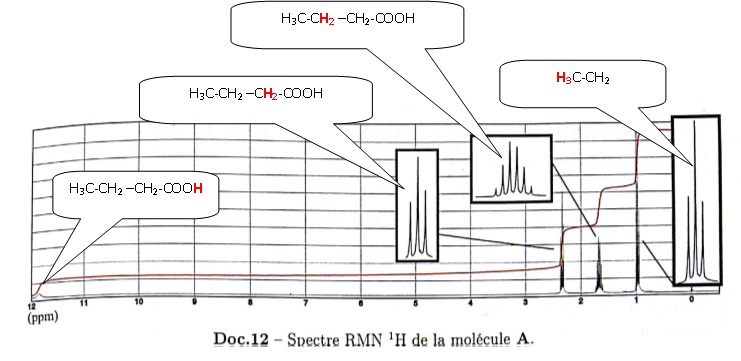
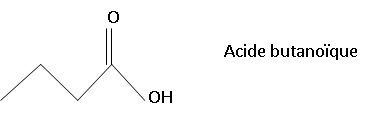
|
|
|
|
On
renouvelle l'expérience de la partie I.C, mais cette fois, on enduit
les bandes de papier d'une huile dérivée de la molécule A. On réalise
des acquisitions analogues et on obtient les courbes suivantes.
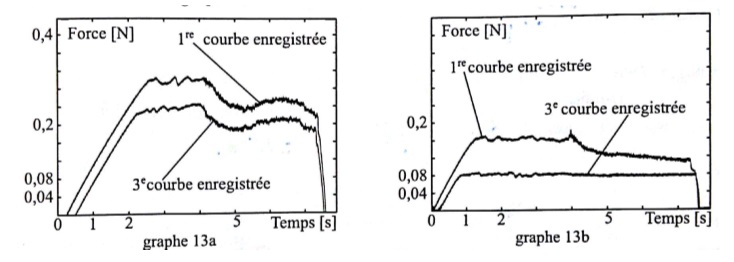
13a : papier enduit par une huile dérivée de A.
13b : courbes obtenues en enduisant le papier par une huile dérivée de l'acide élaïdique.
Adapté de The Friction between Paper Surfaces, N Garoff 2002.
44. Discuter l'intérêt d'utiliser l'huile lubrifiante dérivée de A.
Les coefficients de frottement sont plus faibles ( respectivement 0,3 et 0,24 au lieu de 0,4 et 0,32, expérience 1).
La force nécessaire pour entretenir le glissement sera plus faible en présence d'huile.
Les chercheurs ont également testé une huile dérivée de l'acide
élaïdique( ou acide E-octadé-9-ènoïque ), un acide gras dont la
structure est proche de celle d'un acide gras présent dans l'huile
d'olive ( ou acide Z-octadèc-9-ènoïque ), courbes 13b.
45. Discuter l'intérêt d'utiliser l'huile dérivée de l'acide élaïdique.
Les coefficients de frottement sont encore plus faibles et µs se rapproche de µd.
La force nécessaire pour entretenir le glissement sera encore plus faible.
On considère les deux molécules suivantes. L'une correspond à l'acide élaïdique et l'autre à l'acide oléïque.
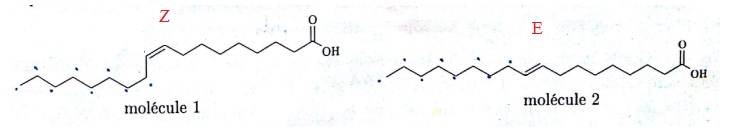
46. Quel lien existe-t-il entre ces deux molécules ?
Diastéréoisomères de type Z E.
47. Identifier l'acide élaïdique.
Molécule 2.
|
|
|
|