Chimie,
école de santé des armées 2016.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Exercice
1. Synthèse organique de l’acide valproïque (6
points)
Le bilan de la première étape de la synthèse de l’acide valproïque est
donné ci-dessous :
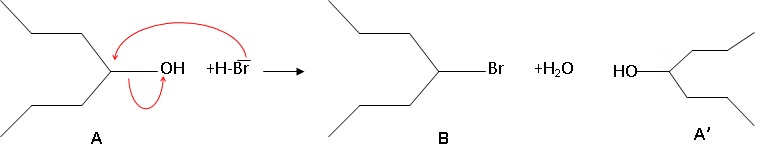
1) À propos du
composé A :
a) Quelles est sa
formule brute ?
C7H16O
b) Dans le bilan ci-dessus, est-il représenté sous une forme de Lewis,
de Cram ou topologique ?
Topologique.
c) La molécule
comporte-t-elle un ou des carbones asymétriques ?
La molécule possède un plan de symétrie ; il n'y a pas de carbone
asymétrique.
d) Donner la
définition d’une molécule chirale. Ce composé est-il chiral ?
Une molécule chirale n'est pas superposable à son image dans un miroir
plan. cette molécule n'est pas chirale.
e) Par rapport au
composé A, le composé A’ donné ci-dessous :
A-t-il les mêmes propriétés physiques ? Justifier.
A-t-il les mêmes propriétés chimiques ? Justifier.
A et A' sont identiques. Ils ont les mêmes propriétés physiques et
chimiques.
2) À propos de la
première étape de la réaction de synthèse de l’acide valproïque :
a) Le composé A
subit-il une modification de groupe ou de chaîne ?
La chaine carbonée ne change pas ; modification de groupe.
b) À quelle
catégorie de réaction cette première étape appartient-elle ?
Substitution de OH par Br.
c) Quel est le site
donneur et quel est le site accepteur lors de la formation de la
liaison carbone-brome ?
Le brome est le site donneur ; le carbone lié au groupe OH est le site
accepteur.
d) Écrire le
mécanisme réactionnel en utilisant le minimum de flèches courbes.
e) En faisant
réagir 0,5 mmol de composé A avec 4 mmol de HBr on obtient 0,2 mmol de
composé B. Quel est le rendement de la réaction ?
Pour une réaction totale, à partir de 0,5 mmol de A on peut obtenir au
mieux 0,,5 mmol de B.
Rendement : 0,2 / 0,5 = 0,4 ( 40 %).
|
....
.....
|
Exercice 2. évolution de la
concentration plasmatique en acide valproïque (2,5 points)
Le graphe ci-dessous représente l’évolution temporelle de la
concentration massique C en acide valproïque
dans le plasma sanguin d’un patient à qui on aurait administré une
masse D = 2,0 g (appelée dose) de
cette molécule de deux manières différentes : en injection
intraveineuse (courbe (a)) ou en administration
par voie orale d’une forme galénique dite « à libération prolongée
(courbe (b)).
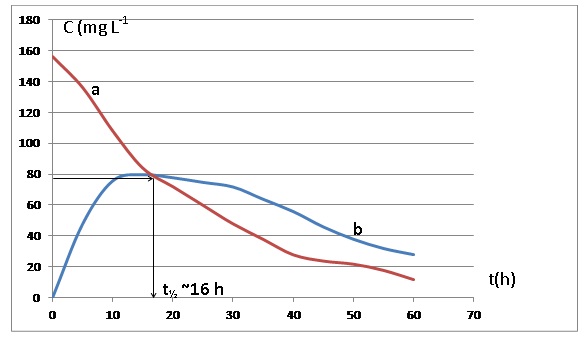
QCM 15 : (0,5 point)
Dans le cas d’une injection intraveineuse, quelle est la valeur du
temps de demi-vie du médicament ?
Pour répondre à cette question, on assimilera le temps de demi-vie au
temps de demi-réaction.
A- Environ 80 g.L-1
B- Environ 16 mg.L-1
C- Environ 16 h Vrai.
D- Environ 46 h
E- Les items A, B, C, D sont faux.
QCM 16 : (1 point)
À l’aide de la concentration plasmatique maximale, quelle est la valeur
du volume dans lequel se
répartissent les molécules d’acide valproïque dans le cas d’une
injection intraveineuse ?
Aides aux applications numériques
1/39 ~ 0,0256 ; 1/40 = 0,0250 ; 1/80 = 0,0125 ; 1/156 ~ 0,0064 ; 1/78 ~
0,0128
A- Environ 1 L
B- Environ 3 L
C- Environ 6,5 L
D- Environ 13 L Vrai.
E- Les items A, B, C, D sont faux.
2 g dans V litre donnent 156 mg /L = 0,156 g/L.
0,156 =2 /V ; V = 2 / 0,156 ~2 x6,4 ~12,8 L
QCM 17 : (1 point)
Les taux thérapeutiques recommandés pour l’acide valproïque sont
compris entre 40 et 100 mg.L-1. Si la
dose d’acide valproïque administrée est D = 2,0 g, pour que sa
concentration plasmatique soit :
A- Au minimum de 100 mg.L-1, il faut utiliser la forme (a)
B- Supérieure à 40 mg.L-1 pendant la durée la plus longue
possible, il faut privilégier la forme (a)
C- Supérieure à 40 mg.L-1 pendant la durée la plus longue
possible, il faut privilégier la forme (b). Vrai.
D- De 80 mg.L-1 au bout de 16 minutes, on peut utiliser
aussi bien la forme (a) que la forme (b)
E- La plus basse possible au bout d’une heure, il faut privilégier la
forme (b). Vrai.
|
|
|
EXERCICE
3 : Dosage de l’acide valproïque d’une gélule de Dépakine® (4,5
points)
On souhaite doser la masse d’acide valproïque dans une gélule de
Dépakine®. Pour cela on ouvre la gélule et on dissout la poudre dans
une fiole de 200 mL. On complète jusqu’au trait de jauge et on prélève
20 mL avec une pipette jaugée qu’on place dans un bécher. On plonge
l’électrode du pH-mètre et on dose par une solution d’hydroxyde de
sodium à 10-2 mol.L-1 ; l’équivalence est obtenue
par un volume de base versé :
Véq = 8,0 mL. La masse molaire de l’acide valproïque est
égale à 144 g.mol-1.
QCM 18 : (0,5 point)
Sachant que le pKa du couple acide valproïque/ion valproate
vaut 4,6, on peut dire que :
A- L’acide valproïque est un acide fort
B- L’acide valproïque est un acide faible. Vrai.
C- L’ion valproate est une base faible. Vrai.
D- L’ion valproate est un base forte
E- Les items A, B, C, D sont faux.
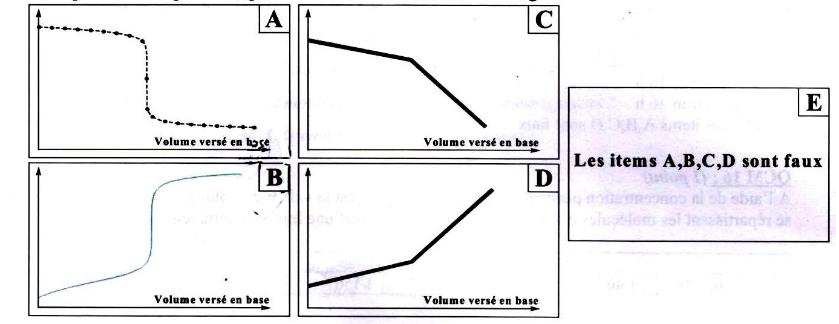
QCM 19
: (0,5 point)
D’un point de vue qualitatif, quelle est l’allure de la courbe de
dosage ? B.
QCM 20 : (1,5 point)
Quelle est, approximativement, la masse d’acide valproïque contenue
dans une gélule de Dépakine® ?
A- 115 mg Vrai.
B- 1,15 g
C- 0,72 g
D- 823 mg
E- 0,101 g
A l'équivalence CaVa = Cb Véq
=0,01 x8 =0,08 mmol dans 20 mL soit 0,8 mmol dans 200 mL.
0,8 x144 =115,2 mg .
QCM 21 : (1 point)
Parmi les espèces du couple acide valproïque/ion valproate, à
l’équivalence du dosage précédent :
A- On trouve quasi-exclusivement de l’acide valproïque
B- On trouve quasi-exclusivement des ions valproate. Vrai.
C- On trouve autant d’acide valproïque que d’ions valproate
D- On trouve plus d’acide valproïque que d’ions valproate
E- On trouve quasiment aucune des deux espèces.
QCM 22 : (1 point)
Quelle peut-être la valeur du pH à l’équivalence du dosage
acido-basique précédent ?
A- pHéq = 2
B- pHéq = 4,6
C- pHéq = 7
D- pHéq = 8. Vrai.
E- pHéq = 14
Présence d'une base faible majoritaire, l'ion valproate, donc pHéq
> 7.
|
|
|
|
EXERCICE 4 : Spectroscopie de la molécule d’acide valproïque (2
points)
QCM 23 : (1 point)
Dans le spectre de Résonance Magnétique Nucléaire de l’acide valproïque
:
F- On trouvera pour cette molécule 5 massifs différents. Vrai.
A- On trouvera pour cette molécule 8 massifs différents
B- Le groupement -CH3 sortira sous forme d’un singulet.
Faux, triplet.
C- L’hydrogène du groupement carboxyle sortira sous forme d’un doublet.
Faux, singulet.
D- Les items A, B, C, D sont faux.
QCM 24 : (1 point)
À partir des données Infra-Rouge ci-dessous, quel est le spectre IR de
la molécule d’acide valproïque ?
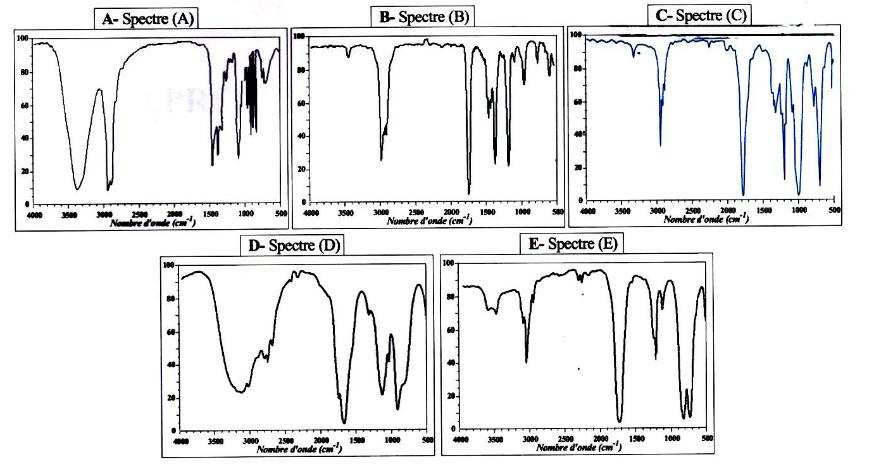
Large bande vers 3200 cm-1 ( OH lié) et bande fine intense
vers 1700 cm-1 ( carboxyle). Spectre D.
|
|