Concours
technicien chimiste Orléans 2016.
En poursuivant votre navigation sur ce site, vous acceptez l’utilisation de Cookies vous proposant des publicités adaptées à vos centres d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Exercice1.
On
effectue, dans du dioxygène, la combustion complète de 1,12 g d’un
hydrocarbure X, non cyclique, de formule brute CxHy (masse molaire 56
g.mol-1). On obtient 3,52 g de dioxyde de carbone (masse
molaire : 44 g.mol-1) et 1,44 g d’eau (masse molaire : 18
g.mol-1).
1- Quelle est la
formule brute de cet hydrocarbure X ?
% masique de carbone : 12 x *100 /56 ou (3,52 *12 / 44) / 1,12
*100= 85,7 %.
x = 85,7 *0,56 / 12 = 4.
% massique d'hydrogène : y *100 /56 ou 1,44 *2 /18 *100 /1,12 =14,3 %.
y = 0,143 *56 =8.
C4H8.
2- Donner la
formule développée de tous les isomères de X et préciser le nom du
composé X sachant qu’il présente une isomérie Z/E. Représenter ces
isomères Z et E.
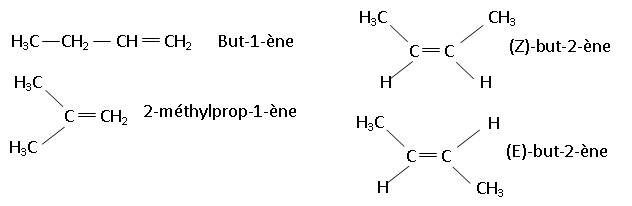
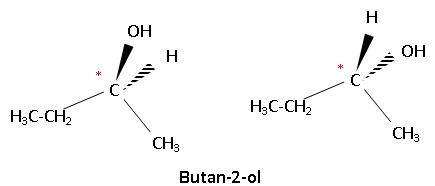
3- Par hydratation, on obtient à
partir de X un alcool secondaire A. Donner sa formule semi-développée
et son nom.
4- Qu’est qu’un
carbone asymétrique ? Indiquer par une notation adaptée le carbone
asymétrique dans la molécule de l’espèce A.
5- Représenter les
deux énantiomères de A.
Un atome de carbone asymétrique est un carbone tétragonal lié à 4
atomes ou groupes d'atomes différents.
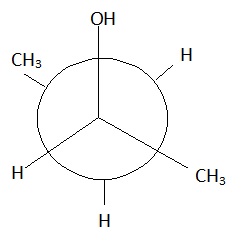
6- Donner une représentation de
Newman de la molécule A en conformation décalée.
|
|
|
Exercice 2. Etalonnage d’une
solution de soude
Un flacon, étiquetée « Solution d’acide sulfurique 0,5 M », a été
conservée après une série de travaux pratiques de licence 1. Le
technicien de laboratoire souhaite le réutiliser pour une nouvelle
série, mais pour cela il a besoin de connaître sa concentration exacte.
Il décide d’opérer un dosage par titrage en utilisant comme support une
réaction acido-basique.
Le protocole noté dans son carnet de laboratoire consiste à préparer
une solution S0 titrée d’hydroxyde de sodium (Na+ + HO-) dans le but de
doser la solution Sx précédente. Il dispose pour cela d’une solution
commerciale S d’hydroxyde de sodium et d’une solution S1 titrée d’acide
sulfurique de concentration molaire C1 = 0,500 mol.L-1, voisine donc de
Cx, qui permettra d’étalonner S1.
1. Etude de la réaction acido-basique
a. L’acide sulfurique est un diacide dont la solution aqueuse est
souvent notée H2SO4 par commodité. La première acidité est forte et la
seconde possède un pKa de 1,9 (à 25°C).
- Donner l’équation de dissociation dans l’eau des 2 acidités :
H2SO4 aq + H2O = HSO4-aq + H3O+aq.
HSO4-aq +H2O = SO42-aq + H3O+aq.
- Le pH d’une solution aqueuse d’acide sulfurique à 0,500 mol.L-1 est très proche de 0. Justifier alors la notation plus acceptable (2 H3O+ + SO42-) fournie pour une solution aqueuse d’acide sulfurique.
pH = -log(H3O+) = 0 ; [H3O+]=1 mol/L. Cela correspond à un diacide fort de concentration 0,5 mol/L.
b. L’ion hydroxyde
est la base la plus forte pouvant exister en solution aqueuse. Le pka
(à 25°C) du couple associé à une valeur de 14.
- Donner l’équation
de la réaction acide-base, telle qu’on devrait l’écrire, pour le
titrage d’une solution d’acide sulfurique par une solution de soude.
H2SO4 aq +HO-aq --> HSO4-aq +H2O.
HSO4-aq +HO-aq -->SO42-aq +H2O.
Ajouter :
Ou encore : diacide fort + soude :
2 H3O+ aq +2HO-aq -->2H2O.
- Quelle
est l’expression et la valeur de la constante d’équilibre correspondant
à cette réaction ? On donne la valeur de la constante d’autoprotolyse
de l’eau Ke = 10-14.
K = [SO42-aq] / ([HO-aq]2[H2SO4 aq]).
avec Ka =[SO42-aq ][H3O+ aq] / [HSO4-aq] = 10-1,9.
et [HSO4-aq] [H3O+ aq] /[H2SO4 aq] = 100 =1.
Soit : [SO42-aq ][H3O+ aq]2 /[H2SO4 aq] =10-1,9.
K = [SO42-aq] [H3O+ aq]2 / ([HO-aq]2[H3O+ aq]2 [H2SO4 aq]).
K = 10-1,9 / (10-14)2 = 1023,1.
c. L’équation utilisée pour les calculs fait intervenir l’entité H2SO4.
- Donner l’équation de la réaction de titrage avec cette notation.
- Pourquoi, selon vous, cette notation est-elle plus commode ?
H2SO4 aq +2HO-aq -->SO42-aq +2H2O.
-
Définir l’équivalence du titrage et donner la relation mathématique
vérifiée par les quantités de matières des réactifs introduits et qui
servira à déterminer la concentration Cx par la suite.
A
l'équivalence, les quantités de matière des réactifs sont en
proportions stoéchiométriques. Avant l'équivalence; l'acide sulfurique
est en excès ; après l'équivalence, l'ion hydroxyde est en excès.
n(HO- )= Csoude Véq ; n( acide sulfurique) = Cx Va ; n(HO- )=2 n( acide sulfurique).
2Cx Va =Csoude Véq ; Cx =Csoude Véq / (2Va).
2. Optimisation du mode opératoire
Le matériel et les produits à disposition sont limités : burettes de 25
mL, béchers de 100 mL, erlenmeyer de 250 mL, pipettes jaugées de 10 mL,
propipettes, éprouvette graduée de 25 mL, pH-mètre, solutions tampons,
agitateur magnétique et barreau aimanté, eau déminéralisée, alcool
éthylique, acétone, indicateurs colorées et les solutions S, S1 et Sx.
Le protocole choisi par le technicien est un dosage colorimétrique mais il dispose dans son carnet de la courbe pH = f(Vtitrant) pour un précédent dosage d’acide sulfurique.
a. Dosage par titrage.
- Qu’est ce qu’un dosage par titrage ?
Un dosage par titrage fait intervenir une réaction chimique rapide et totale.
- Pour une réaction
acido-basique quelle autre méthode physique de suivi peut-on utiliser ?
Dans quel cas est-elle plus intéressante que la pH-métrie ?
La conductimétrie est préférable lorsque le saut de pH est faible à l'équivalence.
b. Choix de l’indicateur coloré
- Des 2 courbes A et B, laquelle correspond à un dosage faisant intervenir les espèces mises en jeu ici. Justifier la réponse.
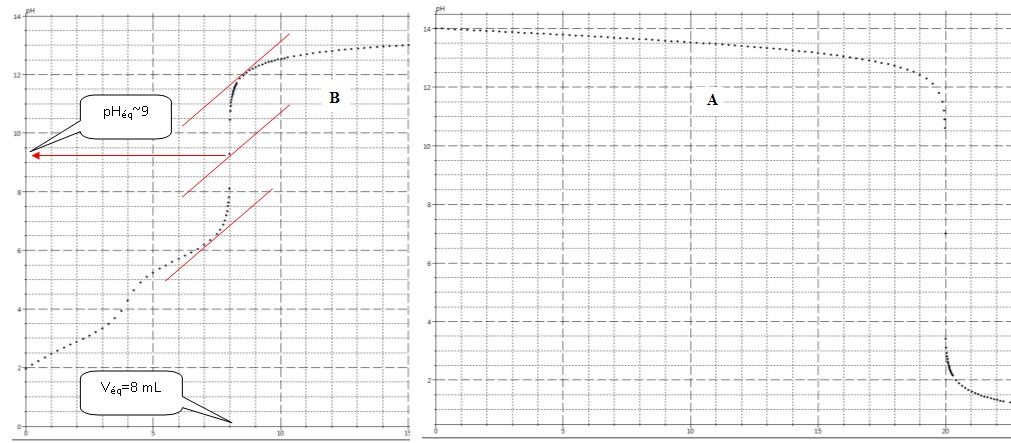
Courbe A : elle présente deux sauts de pH.
La solution titrée est dans l'erlenmeyer et la solution titrante (la
soude) dans la burette. Le pH dans l'erlenmeyer croît au cours du
titrage.
Dans la liste des indicateurs colorés suivantes lequel conviendra au dosage ? Justifier la réponse.
La zone de virage de l'indicateur coloré doit contenir le pH du point équivalent ( 9 dans ce cas). Donc phénolphtaléine.
- En quelle quantité doit être utilisé l’indicateur coloré ? Pourquoi ?
Quelques gouttes d'indicateur coloré ; un indicateur coloré est
constitué d'un couple acide base faible, dont la forme acide et la
forme base ont des teintes différentes. L'indicateur coloré ne doit pas
apporter de grande quantité d'une base ou d'un acide.
c. Choix de la concentration C0 de la solution S0.
- Quelle concentration peut-on proposer pour S0 ? Détailler le raisonnement si on suppose que la soude sera placée dans le bécher lors du dosage.
Le volume d'acide sulfurique ( 0,5 M) versé doit être inférieur au volume de la burette ( 25 mL).
Pour une prise de la solution de soude de 10 mL : n(HO- )=2 n( acide sulfurique).
25 x0,5 x2 = 10 C0 ; concentration maximale de la solution de soude : C0 =2,5 mol / L.
3. Préparation de la solution titrée S0 d’hydroxyde de sodium
a. On donne ci-dessous les caractéristiques de la solution commerciale S récupérées sur le site du fournisseur.
Teneur minimum 30 % ; densité 1,332 à 15°C.
Calculer la concentration molaire approximative C de la solution
commerciale compte tenu des indications ci-dessus. Détailler les
calculs.
Masse minimale d'un litre de soude dans la solution du commerce : 1,332 x 0,30 ~0,40 kg ou 400 g :
C = 400 / M(NaOH) = 400 / 40 = 10 mol/L.
Quel facteur de dilution k faut-il prévoir pour passer de S à S0 ? Quel volume V faudra-t-il prélever si on veut fabriquer un volume de 250 mL ?
Si C0 = 1 mol /L : k = 10 ; il faut prélever 250 / 10 = 25 mL de solution du commerce.
Si C0 = 2,5 mol /L : k = 4 ; il faut prélever 250 / 4 = 62,5 mL de solution du commerce.
b. Le protocole de dilution suivant pourrait être proposé dans un manuel du secondaire :
« Se munir de gants et de
lunettes de protection. Verser un volume raisonnable de solution S dans
un bécher propre et sec. Rincer la pipette choisie avec la solution S.
Prélever le volume nécessaire à l’aide de la pipette jaugée adaptée et
transférer dans la fiole jaugée choisie. Compléter au trait de jauge et
homogénéiser ».
Le protocole prévu par le technicien est le suivant :
« Se munir de gants et de
lunettes de protection. Verser un volume raisonnable de solution S dans
un bécher préalablement rincée à l’eau déminéralisée. Prélever le
volume nécessaire avec l’éprouvette graduée de 25 mL et transférer dans
l’erlenmeyer. Compléter jusqu’à l’indication 250 mL et bien
homogénéiser (5’ à l’agitateur magnétique).
Justifier les choix expérimentaux :
Bécher éventuellement humide
Verrerie : Eprouvette graduée et erlenmeyer
« bien homogénéiser »
Pour S1 : 2C1 Va =Csoude Véq1 ; pour Sx : 2Cx Va =Csoude Véq1 ;
Cx =C1Véq1 /Véq1 =0,5 Véq1 /Véq1 , indépendant de la concentration de la soude.
Il est indispensable d'avoir une solution de soude homogène.
4. Etalonnage de la solution S0 d’hydroxyde de sodium
a. Compléter le schéma du montage en indiquant les positions choisies par le technicien pour S0 et S1 compte-tenu de la nécessité de doser par la suite la solution Sx par S0.
La solution de soude est dans la burette et la solution acide est dans l'erlenmeyer.
b. Dans ce cas préciser le changement de couleur attendu à l’équivalence.
Avant l'équivalence, l'acide sulfurique est en excès, la phénolphtaléine est incolore.
Après l'équivalence, la soude est en excès, la phénolphtaléine donne une teinte rose à la solution.
c. 5 dosages
successifs ont été effectués, les 2 premières valeurs obtenues n’étant
pas concordantes. Le virage de l’indicateur coloré a été obtenu pour :
11,20 mL ; 10,60 mL ; 10,70 mL ; 10,60 mL ; 10,60 mL.
- Donner une raison plausible à la valeur aberrante obtenue.
Mauvaise prise d'essai de la solution acide.
- Les 4 valeurs concordantes sont -elles une indication de précision ou de justesse pour la méthode de dosage ?
Justesse : la moyenne des 4 valeurs expérimentales doit être confondue avec la valeur vraie.
Précision : les valeurs sont données avec 2 décimales.
- Quelle valeur prendra-t-on en compte pour Veq ?
La moyenne des 4 valeurs soit 10,62 mL.
d. La solution S0, si elle doit être réutilisée par la suite, devra être étalonnée à nouveau. Pourquoi son titre diminue-t-il au cours du temps ?
La solution de soude se carbonate au contact du dioxyde de carbone de l'air.
|
|
|
|
Exercice
3.
1. Voici des pictogrammes de sécurité.Donnez leur signification :

2- Que signifie le sigle CMR ?
Cancérogène, mutagène, toxique pour la reproduction
3. Vous devez utiliser de l’acide éthanoïque. Voici les pictogrammes de sécurité :
a) Quels sont les EPI que vous devez utiliser ?
Blouse, gants et lunettes ; travail loin de toute flamme.
.b) Quel est l’autre nom commercial donné à l’acide éthanoïque ? acide acétique.
c) Que doit-on faire en cas de brûlure légère à l’acide ?
Laver à grande eau.
4. Donner le mode
d’évacuation approprié (container spécifique pour déchets solides,
container acide, container base, poubelle, évier, container solvants
halogénés, solvants non halogénés, container acide), pour les produits
suivants :
- Ethanol : solvant non halogéné.
- Flacon en verre ayant contenu du méthanol : container spécifique pour déchets solides.
- Solution d’hydroxyde de sodium à 0.001 mol.L-1 : évier.
- Dichlorométhane : solvant halogéné.
5- Citer 4 EPC qui doivent être dans une salle de travaux pratiques de chimie :
exttincteur, douche, couverture anti-feu, rince-oeil.
6- Quels sont les précautions à prendre avec l’utilisation de l’acide chlorhydrique ? (type d’EPI et de récipients à utiliser) ?
blouse, gants et lunettes ( substance corrosive ) ; pas de récipient métallique.
Exercice 5. Mesure de la masse d’éthanoate de sodium anhydre
Le but de cet exercice est de mesurer la masse d’éthanoate de sodium
anhydre à dissoudre dans 1 litre d’acide chlorhydrique de concentration
10-1 mol/L pour obtenir une solution de pH=2. On admettra que cette addition ne modifie pratiquement pas le volume de la solution.
Afin de résoudre le problème, on indiquera successivement :
- la formule brute de l’éthanoate de sodium anhydre, C2H3O2Na
- la liste des espèces chimiques présentes dans la solution, Na+, C2H3O2-, C2H4O2, Cl-, eau, ion hydroxyde et ion oxonium..
- la concentration en ions H3O+, 10-pH = 0,010 mol/L.
- la concentration en ions OH-. Est-elle majoritaire ou minoritaire ?
10-12 mol/L, minoritaire.
- l’équation d’électroneutralité de la matière, et la relation entres les ions CH3COO- et Na+.
[H3O+]+[Na+]=[Cl-]+[C2H3O2-]+[HO-].
0,010+[Na+]initial~0,10+[C2H3O2- ].
[Na+]initial~0,09+[C2H3O2- ].
- l’équation de conservation de la matière, et la concentration de l’acide éthanoïque.
[C2H3O2- ]initial =[Na+]initial = [C2H3O2- ] + [C2H3O2H ].
[Na+]initial = [Na+]initial-0,09 + [C2H3O2H ].
[C2H3O2H ]= 0,09 mol/L.
- la relation fournie par la constante d’ionisation de l’acide éthanoïque (pKa=4,8).
10-4,8 ~1,58 10-5 = [C2H3O2- ][H3O+] /[C2H3O2H ].
- Le calcul de la concentration en ions CH3COO- déduit de la relation précédente.
[C2H3O2- ] =1,58 10-5 [C2H3O2H] / [H3O+] =1,58 10-5 x0,09 / 0,01 ~1,43 10-4 mol/L.
- Le calcul de la concentration en ions Na+, et en éthanoate de sodium.
[Na+]initial = [C2H3O2- ] + [C2H3O2H ] =1,43 10-4 +0,09 = 0,090143 mol/L
- La masse d’éthanoate de sodium à ajouter à la solution d’acide chlorhydrique.
M(éthanoate de sodium)=82 g/mol ; m = 82 x0,090143 ~7,39 g.
|
|
|
|