Spectrophotométrie,
microscope, ibuprofène,
Bts bioanalyse et contrôle 2017 .
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
.
.
|
|
|
|
|
|
|
|
Spectrophotométrie.
10 points
Une solution affiche une concentration massique en bleu patenté c0
=25,0 g / L.
Masse molaire du bleu patenté : M = 560 g / mol ; largeur de la cuve l = 1,0 cm.
On donne le spectre d'absorption d'une solution diluée de bleu patenté.
1.1. Donner la
longueur d'onde lmax
correspondant au maximum d'absorption.
1.2. Justifier la
couleur de cette solution.
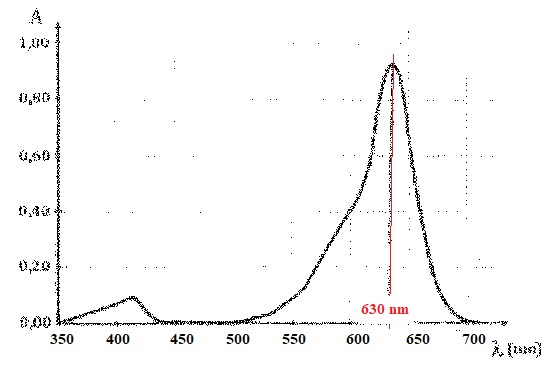
La solution présente un maximum d'absorption vers 630 nm ( orange). La
solution possède la couleur bleue, complémentaire de la couleur orange.
On réalise une série de mesure d'absorbance ( à 640 nm) de
solutions de bleu patenté de concentrations connues.
C(mol/L)
|
3,8
10-6
|
7,1
10-6
|
8,9
10-6
|
1,1
10-5
|
1,4
10-5
|
1,8
10-5
|
A
|
0,28
|
0,58
|
0,72
|
0,88
|
1,12
|
1,42
|
2.1. Ecrire la relation
correspondant à la loi de Beer-Lambert.
2.2. Nommer les
grandeurs et préciser les unités.
A= elc (
A est l' absorbance ou densité
optique)
e ( L mol-1 cm-1)
est une caractéristique de la molécule. Plus e sera
grand, plus la solution absorbe.
l est
l'épaisseur de la cuve ( cm) et c la concentration de la solution ( mol/L).
2.3.Exploiter les mesures pour
établir la relation entre A et C.
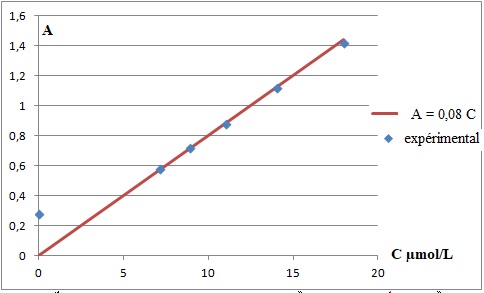
2.4. Montrer que la
gamme d'étalonnage réalisée est de bonne qualité.
Les points expérimentaux sont alignés et la droite passe par l'origine.
Une solution pharmaceutique est trop concentrée. On la dilue d'un
facteur de dilution F = 5000. L'absorbance de la solution diluée vaut A
= 0,68.
3.1. Montrer que Cdiluée
= 8,5 10-6 mol/L.
Cdiluée = 0,68 / 0,08 = 8,5 µ mol/L = 8,5 10-6
mol/L.
3.2. En déduire la
concentration CpH de la solution pharmaceutique.
CpH = 5000 x8,5 10-6 =0,0425 mol/L.
3.3. Calculer sa
concentration massique.
Cm =CpH M = 0,0425 x560=23,8 g/L.
3.4. Les normes
imposent un écart relatif inférieur à 5 %. Vérifier que la solution est
conforme.
(25-23,8) / 25 x100=4,8 %, valeur inférieure à 5 %. La solution est
conforme.
|
....
.....
|
Le microscope. 10 points.
Afin
d'observer la sructure des pattes de gecko on utilise un microscope
muni de trois objectifs marqués x10, x20 et x100.
Taille d'un sétule : 75 µm ; taille d'une spatule : 0,30 µm ;
grossissement de l'oculaire : Goc = 20 ; intervalle optique D = 16,0 cm.
Valeur
absolue du grandissement g
de l'objectif
|
10
|
20
|
100
|
|
Ouverture
numérique O.N
|
0,25
|
0,40
|
1,25
|
|
On
utilise d'abord le microscope avec un objectif de grandissement
de valeur absolue égale à 20. On observe une sétule et on
effectue les réglages pour observer une image à l'infini.
1. Préciser
l'intérêt de former une image finale à l'infini.
L'oeil observe sans accommoder, donc sans fatigue.
2. Donner la
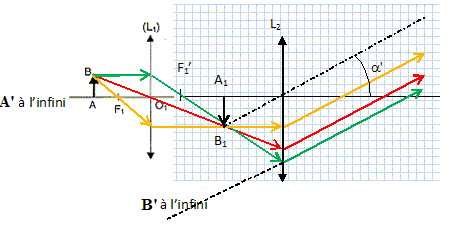
position de l'image intermédiaire A' B' permettant cette observation.
A'B' (A1B1 sur le schéma) se trouve dans le plan
focal objet de l'oculaire.
3. Schématiser le
modèle de microscope décrit, sans soucis d'échelle.
4. Rappeler le grossissement
commercial Gc du microscope en fonction du grandissement g de l'objectif et du
grossissement Goc de l'oculaire Calculer sa valeur.
Gc = |g| Goc
=20 x 20 = 400.
5. Le pouvoir de
résolution est limité par la diffraction. la dimension ABmin
du plus petit objet observable est donné par : ABmin = 0,6 l / O.N.
Déterminer ABmin si l
= 500 nm.
Peut-on obser une sétule ? Une spatule ?
Choisir l'objectif qui permettra d'observer une spatule.
ABmin = 0,6 x500 10-9 / 0,40 =7,5 10-7
m =0,75 µm.
Une sétule de dimension 75 µ est observable. Une spatule de dimension
0,30 µm est trop petite pour être observable dans ces conditions.
Objectif de 100 : ABmin
= 0,6 x500 10-9 / 1,25 =2,4 10-7 m =0,24 µm.
Une spatule de dimension
0,30 µ est alors observable.
|
|
|
Titrage d'un comprimé contenant de
l'ibuprofène. 10 points
L'ibuprofène( noté RCOOH, pKa
= 4,5, M = 206,0 g/mol ) contenant une fonction acide
carboxylique, on peut le titrer en réalisant un titrage acido-basique.
Un comprimé est dissout dans de l'eau distillée pour obtenir un volume
V = 40,0 mL. La solution est notée S. Le titrage est suivi par
pH-métrie. La solution titrante d'hydroxyde de sodium a une
concentration Cb = 0,20 mol/L.
Equation support du titrage : RCOOH aq + HO-aq --> RCOO-aq
+ H2O(l).
1. Exprimer la
constante K associée à cette réaction en fonction de Ka et Ke.
Calculer K et conclure.
Ka = [H3O+] [RCOO- ] /
[RCOOH].
Ke =[H3O+]
[HO- ].
K = [RCOO- ] / ([RCOOH][HO- ]) = Ka / Ke.
K = 10-4,5 / 10-14 = 109,5= 3,16 109.
K étant très grand, la réaction est totale.
2.1. Donner la
définition de l'équivalence d'un titrage.
A l'équivalence, les quantités de matière des réactifs sont en
proportions stoechiométriques.
2.2. Déterminer les
coordonnées du point d'équivalence.
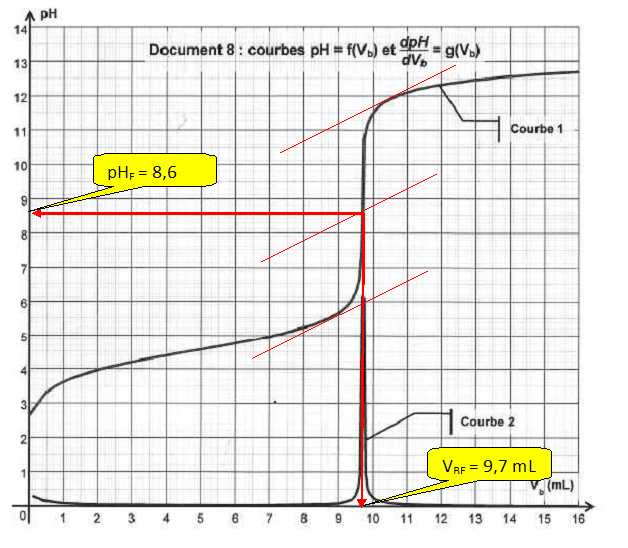
2.3. Déterminer la quantité de
matière d'ibuprofène et en déduire la masse d'ibuprofène dans un
comprimé.
9,7 10-3 x 0,20 = 1,94 10-3
mol.
m = 1,94 10-3 x206 ~0,40 g.
2.4. Calculer le
nombre maximal de comprimé qu'un adulte peut ingérer en une journée.
Maximum conseillé : 1,2 g par jour soit 3 comprimés.
|
|