La pollution par
les nitrates.
bac S Amérique du Nord 2017.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
|
|
Les
ions nitrate ( NO3-) sont présents naturellement
dans les eaux souterraines et superficielles en faibles quantités,
généralement inférieures à 1 mg.L–1. Ils participent à
l’équilibre de l’écosystème en intervenant notamment dans le
développement de certaines plantes et microorganismes.
Cependant, leur utilisation massive comme engrais dans les cultures et
leur rejet par les élevages entrainent aujourd’hui une forte
augmentation de leur concentration dans les nappes phréatiques et les
cours d’eau environnants. Les ions nitrate contenus dans le sol
constituent désormais la cause majeure de pollution des grands
réservoirs d’eaux souterraines du globe terrestre.
Les dangers sont réels pour l’environnement et la santé. L’Organisation
Mondiale de la Santé préconise, pour une personne, de ne pas consommer
plus de 3,65 mg d’ions nitrate par kilogramme de masse corporelle et
par jour. La législation française impose donc une teneur inférieure à
50 mg.L–1 dans les eaux de consommation.
Les eaux présentant un taux d’ions nitrate supérieur à la norme
nécessitent donc un traitement spécifique pour pouvoir être consommées.
Pour lutter contre cette pollution, on utilise des bactéries
dénitrifiantes ou des résines échangeuses d’ions (REC).
La
résine échangeuse d’ions utilisée comporte des petites billes poreuses,
de diamètre 0,6 mm, saturées en ions échangeables (soit des ions
chlorure, soit des ions hydrogénocarbonate). Au contact de cette
résine, les ions nitrate présents dans une eau polluée vont s’échanger
avec les ions chlorure et prendre leur place sur la résine, ce qui
permet d’éliminer la majeure partie des
ions nitrate dans l’eau en les remplaçant par des ions chlorure.
L’objectif
de l’étude est de vérifier si le traitement, par une résine échangeuse
d’ions d’une eau polluée par les nitrates a permis de rendre cette eau
potable. Pour cela on met en oeuvre le protocole suivant :
Titrage des ions nitrate présents dans une eau après traitement sur une
REC :
Étape 1 :
Introduire un volume VEAU = 50 mL d’eau à analyser dans un
erlenmeyer.
Ajouter un volume de 10 mL d’acide sulfurique (2H+(aq) + SO42-
aq) pour acidifier le mélange réactionnel.
Ajouter un volume V1 = 100 mL d’une solution aqueuse de sel
de Mohr Fe(SO4)2(NH4)2, 6H2O
de concentration molaire C1 = 1,00 mmol.L–1 de
manière à apporter une quantité de matière initiale d’ions fer (II) ni
(Fe2+ ) en excès.
Chauffer le mélange au bain-marie pendant 45 min ; ce qui permet de
rendre totale la transformation des ions nitrate de l’eau en monoxyde
d’azote (g).
On refroidit le mélange.
Étape 2 :
On introduit dans une burette une solution aqueuse de permanganate de
potassium (K+aq+ MnO4- aq) de
concentration molaire C2 = 3,0 × 10-4 mol.L–1.
On titre les ions fer (II) restant, nrestant( ) dans l’erlenmeyer en
versant la solution de permanganate de potassium.
On repère l’équivalence grâce à un changement de couleur du mélange
réactionnel.
On trouve un volume à l’équivalence de VE =11,3 mL pour
l’eau analysée.
|
|
|
Questions préliminaires:
1- Identifier la
réaction chimique mise en oeuvre lors de la première étape du
protocole. Justifier.
Oxydation des ions fer (II) en ion fer (III) par les ions nitrate en
milieu acide.
Couples oxydant /réducteur : Fe3+ / Fe2+ ; NO3-
/ NO(g).
3Fe2+aq
+ NO3- aq+4H+aq = NO(g) +3Fe3+aq
+2H2O(l)..
2-
Préciser les ions majoritairement présents dans l’erlenmeyer lors de
cette première étape :
- avant l’ajout de la solution aqueuse de sel de Mohr ;
NO3- aq ; (2H+(aq)
+ SO42- aq) ; chlorure ( après passage sur la
résine échangeuse d'ions).
- au bout des 45 min de chauffage au
bain-marie.
Fe3+aq
; (2H+(aq)
+ SO42- aq), Fe2+aq ( en excès ); NH4+aq
( apportés par le sel de Mohr ); chlorure.
3-
À partir des demi-équations électroniques, vérifier l’équation de la
réaction chimique correspondant à la deuxième étape du protocole.
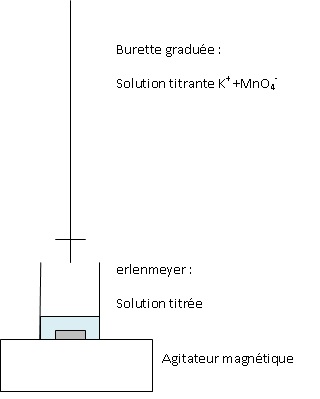
Schématiser et légender le montage utilisé dans cette étape.
5 Fe2+aq =5 Fe3+aq + 5e-.
MnO4- aq+
8H+ aq+5e- =Mn2+ aq+ 4H2O(l).
MnO4- aq+ 8H+ aq+5 Fe2+aq =Mn2+ aq+ 4H2O(l) +5 Fe3+aq.
|
|
|
..............
.................
|
Problème :
Peut-on considérer que la technique de dénitratation utilisée est
suffisamment efficace pour que l’eau initialement polluée soit
considérée comme potable ? Quelle quantité maximale de cette eau un
enfant de 35 kg peut-il boire sans conséquences néfastes pour sa santé ?
A l'équivalence : n(Fe2+) excès = 5n(MnO4-) = 5C2 VE=
5x3,0 × 10-4 x11,3 10-3 =1,695 10-5
mol.
n(Fe2+)
initial =C1
V1 = 1,00 10-3 x0,100 = 1,00 10-4 mol.
n(Fe2+)
ayant réagi =1,00 10-4
-1,695 10-5 = 8,305 10-5 mol.
Or : 3Fe2+aq
+ NO3- aq+4H+aq = NO(g) +3Fe3+aq
+2H2O(l).
n(NO3- aq) = n(Fe2+)
ayant réagi /
3 = 8,305 10-5 / 3 =2,768 10-5 mol dans 50 mL d'eau.
Concentration résiduelle des ions nitrate dans l'eau : 2,768 10-5
/ 0,050 = 5,54 10-4 mol/L.
Concentration massique correspondante ( M(NO3-) = 62 g/mol) :
5,54 10-4 x 62 ~3,4 10-2 g / L
ou 34 mg /L.
La législation française impose donc une
teneur inférieure à
50 mg.L–1 dans les eaux de consommation.
L'eau est considérée comme potable.
Une personne, de ne pas consommer
plus de 3,65 mg d’ions nitrate par kilogramme de masse corporelle et
par jour.
3.65 x35 ~128 mg.
128 /34 ~3,8 L.
Cette quantité est bien supérieure à la consommation d'eau journalière.
La consommation d'eau n'est pas responsable d'un excès de nitrate.
D'autres aliments, charcuterie, carottes, apportent des nitrates.
|
|
|
|