Les
sciences permettent d’analyser et de comprendre les performances des
athlètes. Les scientifiques
s’intéressent à la physique, à la biomécanique, à la physiologie et aux
transformations chimiques intervenant lors des pratiques sportives.
Dans cet exercice, on s’intéresse à la pratique d’un sport d’endurance
: le cyclisme.
L’exercice est constitué de deux parties indépendantes :
- partie 1 : Calcul des puissances développées par les cyclistes ;
- partie 2 : Étude de la physiologie de l’effort et régulation du pH
sanguin.
Partie 1 : Calcul des puissances
développées par les cyclistes.
Afin d’améliorer les performances des cyclistes, on utilise une méthode
de calcul indirect des puissances qu’ils fournissent lors d’un effort.
Cette méthode s’appuie sur un modèle qu’il faut valider en le comparant
avec les
données mesurées en temps réel pendant l’effort grâce à un capteur
(boitier SRM) placé sur le pédalier.
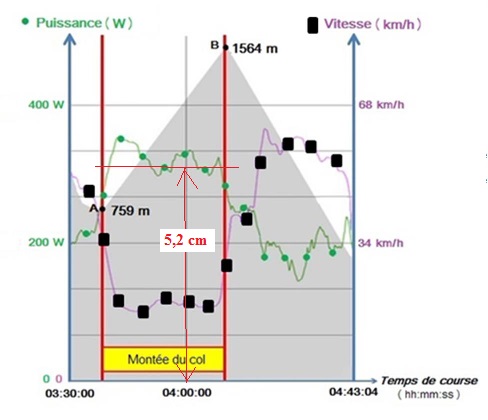
Dans cette partie, on s’intéresse à l’ascension par un cycliste du col
pyrénéen de la Hourquette d’Ancizan. Il effectue cette montée, longue
de 10,4 km, en 31 min et 51 s.
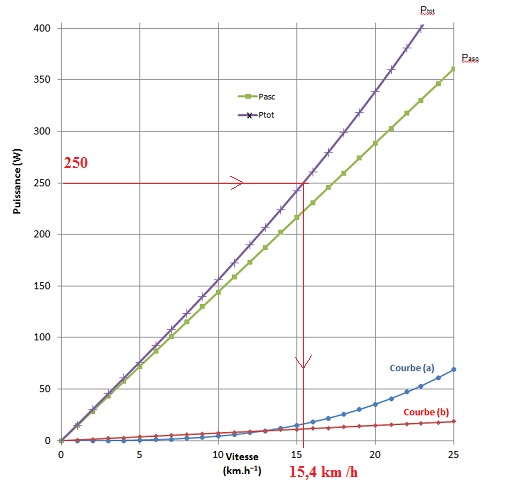
Dans le modèle théorique, on considère que la puissance totale P
tot
développée par le cycliste, lors de la montée, va permettre de :
- vaincre les forces de pesanteur pour permettre l’ascension (P
asc)
;
- lutter contre les frottements mécaniques des roues sur le bitume (P
roulement)
;
- contrer les frottements de l’air (P
air).
Dans ce modèle, les puissances P
asc et P
roulement
sont proportionnelles à la vitesse du cycliste alors que P
air
est proportionnelle au cube de cette vitesse.
Le modèle théorique utilisé permet de construire le graphique suivant
qui donne les valeurs des différentes puissances en fonction de la
valeur de la vitesse lors de l’ascension du col.
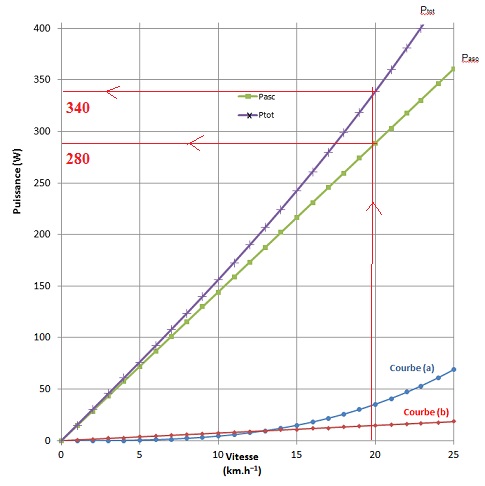
Données :
Intensité de la pesanteur g = 9,8 m.s
–2.
Pour une puissance constante sur la durée considérée, la
variation d’énergie E s’exprime par :
E = P. t , avec E en joule, t en seconde et P en watt.
On étudie le système S {cycliste, équipement, vélo} de masse m= 67,8
kg. On suppose que l’ascension
se fait à vitesse v constante et à puissance P
tot constante.
1. Questions préliminaires
1.1. Dans quel
référentiel sont effectuées les mesures ?
Les mesures sont effectuées dans le référentiel terrestre supposé
galiléen.
1.2. Montrer que la
vitesse moyenne du cycliste, lors de l’ascension, vaut
v = 19,6 km.h
–1.
31 min 51 s = 31 x60 +51 = 1911 s ;
v = distance / durée = 10,4 10
3 / 1911 =5,44 m /s ou 5,44
x3,6 = 19,6 km /h.
1.3. Définir
l’énergie mécanique E
m d’un système. Que peut-on dire alors
de l’évolution de cette
énergie lors de l’ascension ?
L'énergie mécanique est la somme de l'énergie cinétique et de l'énergie
potentielle.
L'énergie cinétique reste constante. L'énergie potenteillle -( origine
au pied du col) augmente. l'énergie mécanique croît lors de l'ascension.
2. Étude de
l’ascension du col par le cycliste et validation du modèle de calcul de
puissances.
On cherche à valider le modèle proposé en utilisant les données du
capteur SRM lors de l’ascension du col par le cycliste.
2.1. Donner
l’expression littérale de la variation d’énergie potentielle de
pesanteur E
pp du système entre le pied et le sommet du col
de la Hourquette d’Ancizan, en fonction de m, g et de Z
A et Z
B,
(respectivement altitudes du pied (759 m) et du sommet du co ( 1564
m)l).
Montrer que E
pp = 5,3 × 10
5 J.
E
pp = mg(z
B-z
A) = 67,8 x9,8 (1564-759)=
5,3 × 105 J.