Les
esters ont des arômes souvent agréables et fruités, et sont utilisés
dans l’industrie alimentaire pour reproduire des arômes de fruits. Leur
synthèse, qui nécessite l’utilisation d’un alcool et d’un acide
carboxylique, est généralement facile à réaliser en laboratoire.
Présentation de
la réaction d’estérification
L'estérification est une réaction chimique permettant de former un
ester à partir d’un acide carboxylique et d’un alcool.
En se plaçant dans un cas général, si l’acide carboxylique a pour
formule R
1—CO
2H et l’alcool R
2—OH,
alors l’ester formé sera R
1—CO
2—R
2
selon la réaction d’équation :

R1 et R2 sont des groupements alkyles.
Partie 1 :
étude du mécanisme réactionnel de la réaction d’estérification On
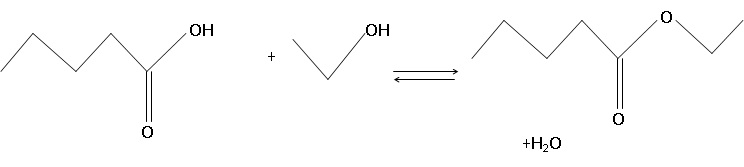
s’intéresse à la réaction de formation d’un ester à partir d’acide
pentanoïque et d’éthanol.
1.1. Écrire
l’équation de la réaction de cette synthèse en utilisant les formules
topologiques des espèces mises en jeu.
 1.2.
1.2. Le spectre
infrarouge du produit obtenu après extraction est présenté ci-dessous.
Quelles informations sur ce spectre permettent de savoir si la réaction
a bien eu lieu ?
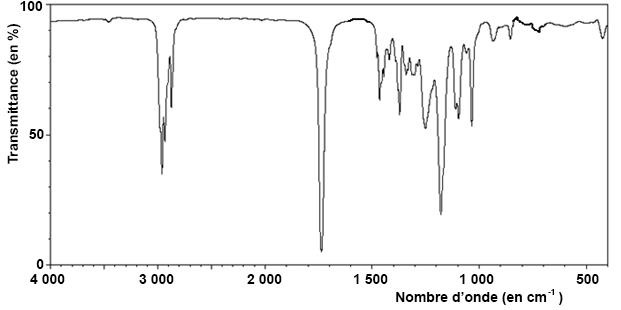
Disparation de la large bande vers 3200 cm
-1 due à la
présence de OH lié par liaison hydrogène.
1.3. La réaction
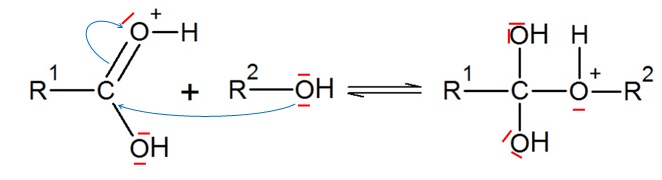
présente un mécanisme réactionnel, en plusieurs étapes. L’une des
étapes est représentée ci-dessous.
1.3.1. Reproduire
cette étape sur la copie. Ajouter les doublets non liants manquants et
représenter la (les) flèche(s) courbe(s) rendant compte de cette étape.
1.3.2. À
quelle catégorie de réaction appartient cette étape ?
A partir de deux réactifs, on obtient un seul produit ; une double
liaison C=O disparaît.
Réaction d'
addition sur la
liaison C=O.