Des panneaux
solaires hybrides,
bac
STLB Polynésie 2017.
|
|
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
|
|
Partie A : le solaire photovoltaïque.
8 points
A.1. Panneaux solaires
photovoltaïques.
A.1.1. On estime
qu’une maison a besoin d’une installation pouvant fournir 3 kWc
(kilowatt crête).
Déterminer le nombre de panneaux solaires à installer et leur surface
totale.
Puissance nominale : 250 Wc.Longueur : 1677 mm ; largeur : 990 mm.
Nombre de panneaux : 3 / 0,25 = 12.
Surface des panneaux : 122 x1,677 x 0,99 19,93 ~ 20 m2.
A.1.2. Par ciel
bleu et clair, le rayonnement solaire peut atteindre 1000 W.m –2.
Déterminer la puissance reçue par un panneau photovoltaïque, puis par
l’ensemble des panneaux hotovoltaïques.
1000 x1,667 x0,99 =1650 W = 1,65 kW.
1,65 x 12 =19,8 ~ 20 kW.
A.1.3. Définir et
déterminer le rendement du panneau solaire.
Rendement = puissance électrique crète / puissance solaire reçue =0,25
/ 1,65 = 0,152 ( ~ 15,2 %).
A.1.4. Comparer la
valeur trouvée avec la valeur du rendement du module photovoltaïque. Ce
résultat est-il en accord avec la valeur et la tolérance en % données
par le constructeur ?
Rendement 15,40
%. ; tolérance -1% /+ 3%.
Soit 14,4 % ; 18,4 %. La valeur trouvée, 15,2 % appartient à cet
intervalle. Donc accord.
A.2 Étude d’une cellule
photovoltaïque au laboratoire.
On réalise au laboratoire l’étude d’une cellule photovoltaïque. On
dispose d’une résistance variable, d’un ampèremètre, d’un voltmètre et
d’une lampe à incandescence de puissance nominale 40 W.
La cellule photovoltaïque est placée en série avec la résistance
variable. Pour différentes valeurs de R, on relève ensuite la tension
aux bornes de la cellule et l’intensité du courant dans le circuit.
A.2.1. Faire le
schéma électrique associé à ce montage.
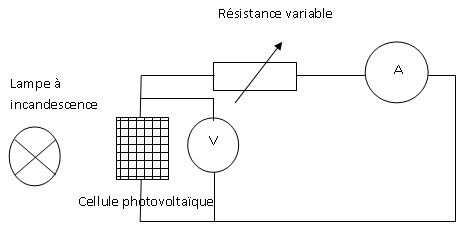
A.2.2. On relève
expérimentalement les grandeurs suivantes pour une cellule de surface
26,1 cm2 et une puissance reçue de 0,75 W émise par une
lampe à incandescence placée à 10 cm de la cellule.
R(ohm)
|
260
|
170
|
110
|
80
|
60
|
50
|
30
|
20
|
0
|
U(V)
|
1,97
|
1,93
|
1,87
|
1,78
|
1,56
|
1,33
|
0,82
|
0,57
|
0
|
I(mA)
|
7,58
|
11,4
|
17,0
|
22,3
|
26,0
|
26,6
|
27,3
|
27,5
|
28,0
|
P(W)
|
0,15
|
0,22
|
0,32
|
0,34
|
0,41
|
0,35
|
0,22
|
0,16
|
0,01
|
En circuit
ouvert la tension est de 2,06 V.
Tracer la courbe représentant l’intensité I du courant en fonction de
la tension U : I = f(U)
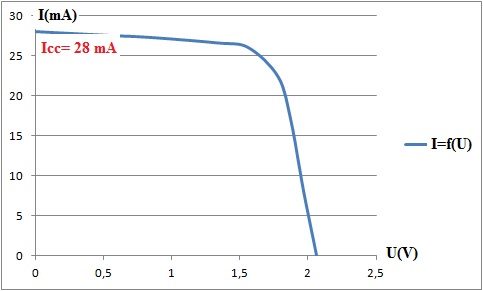
A.2.3. Déterminer
et justifier à partir du graphique la tension à vide et l’intensité de
court-circuit.
A.2.4. Déterminer
la puissance maximale.
En déduire le rendement de la cellule photovoltaïque du laboratoire.
Caractéristique puissance-tension de la cellule photovoltaïque utilisée
au laboratoire
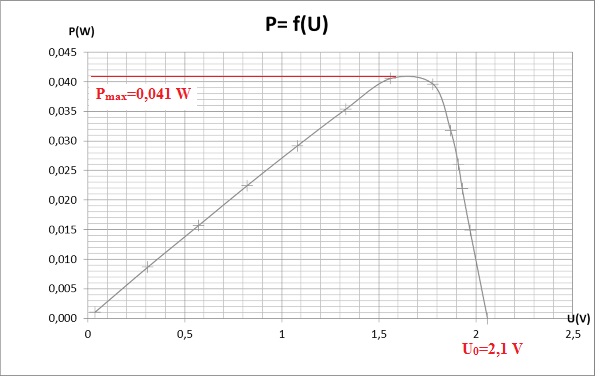
Rendement : Pmax / puissance émise par la lampe = 0,041 /
0,75 = 0,055 (5,5 %).
A.2.5. Sachant que
le rendement théorique de cette cellule est égal à 15%, proposer des
hypothèses permettant d’expliquer l’écart avec la valeur déterminée à
la question A.2.4.
Le spectre de la lampe est différent de celui du soleil.
Le rendement de 15 % est obtenu dans des conditions de test
standard prédéfinies. Une de ces
conditions standard est un rayonnement solaire optimal de 1 000 watts
par mètre carré.
La cellule de surface 26,1 cm2 reçoit une
puissance de 0,75 W soit 0,75 / (26,1 10-4) =288 W m-2.
|
....
.....
|
Partie B: le solaire thermique (6,5
points)
Le principe de fonctionnement du panneau thermique est décrit
ci-dessous.
Le principe de base est simple, le liquide chauffé par les capteurs
solaires transite via les tuyaux du circuit primaire, étanche et
calorifugé, jusqu’au serpentin à l’intérieur du ballon d’eau chaude,
puis l’eau au contact de cet échangeur thermique se réchauffe.
Le liquide caloporteur circule en circuit fermé, soit naturellement,
soit à l’aide d’un circulateur électrique. Le liquide caloporteur
s’élève naturellement tant qu’il est plus chaud que l’eau du ballon
grâce à sa différence de densité, c’est le principe du système à
thermosiphon. Dans ce cas le ballon doit se situer au-dessus du capteur.
Sinon, en France dans la majorité des cas, le liquide caloporteur est
propulsé dans le circuit à l’aide d’une pompe électrique : le
circulateur. Un régulateur analyse à l’aide de sondes les
températures, si la sonde du ballon est plus chaude que celle du
capteur, la régulation coupe le circulateur, sinon, le circulateur est
remis en route et le liquide primaire réchauffe l’eau sanitaire du
ballon..
La surface du panneau hybride (photovoltaïque / thermique) DUALSUN est
de 1,66 m2. La
puissance reçue par ce panneau est de 1660 W. On considère que le
fluide caloporteur est de l’eau de masse volumique r = 1000 kg.m–3
et de capacité thermique massique Ceau = 4180 J.kg–1.°C–1.
Son débit par unité de surface dans le panneau
thermique est de 70 L.h–1.m–2.
B.1. Compléter le
schéma du bilan énergétique.
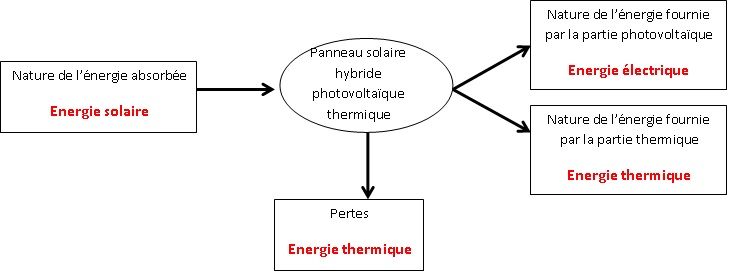
B.2. Calculer
l’énergie reçue en wattheure pendant une heure de fonctionnement pour
le même rayonnement solaire de 1000 W.m–2. Donner sa valeur
en joule.
Energie (J)= Puissance (W) x durée ( seconde) ; Q= 1660 x3600 = 5,976 106 J.
B.3. Calculer le
volume en litres de fluide circulant dans le panneau durant une heure.
V = 70 x 1,66 = 1,162 102 ~1,2
102 L ou 0,1162 m3.
B.4. Vérifier que
la masse de ce volume de fluide est de 116,2 kg.
m = r V = 1000 x
0,1162 = 116,2 kg.
B.5. En négligeant
l’énergie utilisée par la partie photovoltaïque, déterminer l’élévation
de température du fluide provoquée par l’exposition au soleil de ce
panneau durant une heure.
Q = m Ceau Dq
; Dq = Q /(mCeau) =
5,976 106 /(116,2 x 4180) =12,3
°C.
B.6.
Le fluide caloporteur est en réalité un mélange eau / propylène-glycol.
Expliquer pourquoi on ne peut pas utiliser directement l’eau comme
fluide caloporteur. Justifier l’utilisation d’un mélange eau /
propylène-glycol.
L'hiver, l'eau peut geler et les canalisations éclater. L'eau et le
propylène glycol sont miscibles ; le propylène glycol est utilisé comme
antigel.
B.7. Donner à
partir de la formule topologique, la formule semi-développée du
propylèneglycol.
B.8. Sur la formule
semi-développée du propylène-glycol, entourer et nommer les groupements
fonctionnels présents dans cette molécule.
B.9. Indiquer la
signification du pictogramme de sécurité associé au propylène-glycol.
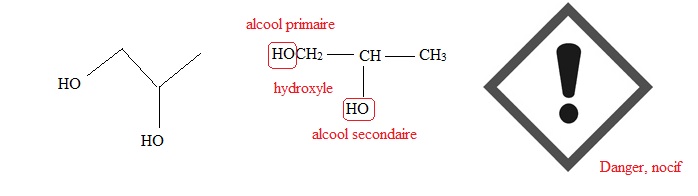
|
|
|
Partie C
: stockage de l’énergie photovoltaïque (5,5 points)
C.1.
Dimensionnement du stockage
C.1.1.Déterminer la
demande énergétique quotidienne D d’un foyer français.
La consommation moyenne en 2015 pour un foyer français est donc de 4
763 kWh.
D =4763 / 365 =13,05 ~13 kWh / jour.
C.1.2. Calculer la
capacité C du parc de batteries à installer, sachant que l’on souhaite
une profondeur de décharge de 50% maximum afin de préserver la durée de
vie des batteries.
C = D N / (L U).
U =12 V, tension en volt ; L : profondeur de décharge maximum ; Q
(Wh / jour ) ; N = 5 jours de réserve.
C = 13 x 5 /(12 x 0,5) = 10,83 ~10,8 kWh V-1 ou 1,08 104 Ah.
C.1.3. Déterminer
le nombre de batteries nécessaires pour assurer 5 jours de réserve.
Capacité nominale de la batterie : 503 Ah.
Nombre de batterie : 1,08 104 / 503 = 21,5 ~22.
|
|
|
|
C.2.
Décharge d’une batterie au plomb
Une batterie au plomb est constituée d’une électrode
de plomb et d’une électrode d’oxyde de plomb.
À la borne négative le plomb réagit selon l’équation suivante :
Pb = Pb 2+ + 2 e –.
À la borne positive l’oxyde de plomb réagit selon l’équation suivante :
PbO2 + 4 H + + 2 e – = Pb 2+
+ 2 H2O
C.2.1. Indiquer, en
justifiant votre réponse, la nature de la réaction se produisant à
chacune des électrodes. En déduire à quelle borne correspond l’anode.
Pb
= Pb 2+ + 2 e –. Une oxydation ( perte
d'électrons ) a lieu à l'anode négative.
PbO2
+ 4 H + + 2 e – = Pb 2+ + 2 H2O.
Réduction ( gain d'électrons ) à la cathode positive.
C.2.2. Écrire l’équation de
fonctionnement de cette batterie.
Pb
= Pb 2+ + 2 e –.
PbO2
+ 4 H + + 2 e – = Pb 2+ + 2 H2O.
Ajouter et simplifier : PbO2
+ 4 H + + Pb = 2Pb 2+ + 2 H2O.
C.3. Charge d’une batterie au plomb
C.3.1. Écrire
l’équation de la charge de cette batterie.
2Pb
2+ + 2 H2O = PbO2
+ 4 H + + Pb.
C.3.2.
Pendant la charge de la batterie, indiquer en justifiant votre réponse,
si l’électrode de plomb est le siège d’une oxydation ou d’une réduction.
Pb 2+ + 2 e – = Pb, gain d'électrons lors d'une
réduction.
Au
cours de la charge, quand la batterie approche de son état de charge
maximale, des bulles de dihydrogène et de dioxygène sont observées aux
électrodes de la batterie. Ces gaz proviennent de l'électrolyse de
l'eau contenue dans l'électrolyte. Les couples oxydants / réducteurs en
présence sont (O2 / H2O) et (H2O / H2).
C.3.3. Écrire la
demi-équation électronique se produisant à l’électrode reliée à la
borne positive du générateur.
Perte d'électrons, oxydation de l'eau : 2H2O = O2
+4H+ +4e-.
C.3.4. Écrire la
demi-équation électronique se produisant à l’électrode reliée à la
borne négative du générateur.
Gain d'électrons, réduction de l'eau : 4H2O + 4e- =2
H2 + 4HO-.
C.3.5. Écrire la
réaction d’électrolyse de l’eau.
2H2O = O2 + 2H2.
C.3.6. Quelle
conséquence peut avoir le dégagement de dihydrogène lors de l’état de charge maximale ?
Le mélange
dihydrogène air est détonnant pratiquement en toute proportion.
|
|