La course à pied est l’un des meilleurs moyens de s’entretenir
physiquement.
La chimie et la physique apportent des réponses aux questions que peut
se poser le coureur.
Exercice 1(7,5
points) :
Quel sucre pour s’alimenter
et que devient-il pendant l’effort ?
1. Le glucose et le
fructose ont les formules semi-développées suivantes :
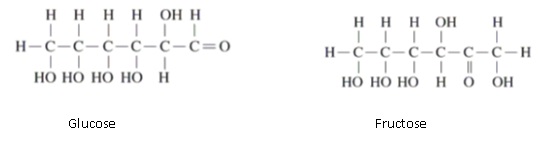 1.1
1.1 Déterminer la
formule brute de ces deux molécules.
C
6H
12O
6.
1.2 Expliquer
pourquoi ces deux molécules sont isomères.
Ces molécules ont la même formule brute et des formules
semi-développées différentes.
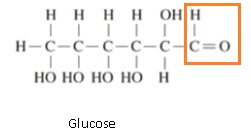
1.3 Nommer la
molécule qui possède le groupe caractéristique d’un aldéhyde et
représenter ce groupe.
 2.
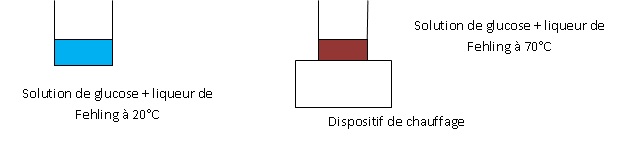
2. Une solution
aqueuse de glucose réagit avec le réactif de Fehling de couleur bleue.
Décrire par un schéma annoté ce test de caractérisation du glucose par
le réactif de Fehling.
 3.
3. Un sportif
prépare trois jours avant son marathon, un bidon d’un volume de 1,0 L
d’une solution aqueuse de glucose de concentration C égale à 0,20 mol.L
-1.
Calculer la masse m de glucose dont ce sportif a besoin pour préparer
cette solution.
Donnée : Masse molaire du glucose : M = 180,0 g.mol
-1.
n = 0,20 mol ; m = n M=0,20 x180 =
36 g.
4. Expliquer
pourquoi ce sportif privilégie une boisson au glucose plutôt qu’au
fructose.
Le muscle assure ses réserves en glycogène uniquement à partir de
glucose, en effet le fructose ne peut pas pénétrer dans le muscle faute
de récepteurs.
Le sportif ne court pas pour maigrir. Il a besoin de stocker de
l'énergie pour le jour de la course.
5. Lors de l’effort
sportif, le glucose est dégradé par l’organisme en acide pyruvique.
Selon les conditions d’oxygénation, l’acide pyruvique sera dégradé à
son tour soit en dioxyde de carbone et en eau (milieu aérobie), soit en
acide lactique (milieu anaérobie). Dans la suite, on s’intéresse à la
transformation de l’acide pyruvique en acide lactique suite à une
oxygénation insuffisante.
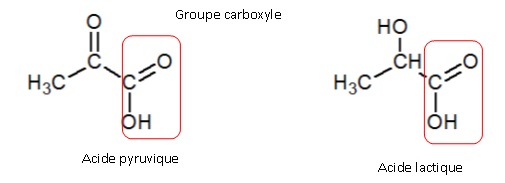
5.1 Préciser, à
l’aide des formules semi-développées, l’origine du caractère acide de
ces deux molécules.
 5.2
5.2 L’acide
lactique possède un atome de carbone asymétrique. Recopier cette
molécule et repérer par un astérisque l’atome de carbone asymétrique.
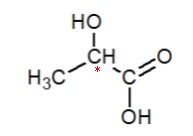 5.3
5.3 Expliquer le
caractère asymétrique de cet atome de carbone.
Un atome de carbone asymétrique est lié à 4 atomes ou groupes d'atomes
différents.
5.4 Nommer la
propriété que donne la présence de cet atome de carbone asymétrique à
la molécule.
Une molécule possédant un atome de carbone asymétrique est chirale.
5.5 L’acide
pyruvique se transforme en acide lactique en milieu insuffisamment
oxygéné.
On donne la demi-équation correspondant au couple oxydant réducteur
acide pyruvique/ acide lactique (CH
3 -CO-COOH/ CH
3
-CHOH-COOH) :
CH
3 -CO-COOH + 2 H
+ + 2 e
- = CH
3
-CHOH-COOH
L’acide pyruvique subit une réduction lorsqu’il se transforme en acide
lactique. Proposer une explication.
L'acide pyruvique gagne des électrons, c'est un oxydant qui se reduit.