Les éponges à
hydrogène, une révolution.
bac S Pondichéry 2017.
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
|
|
1. Questions préliminaires.
1.
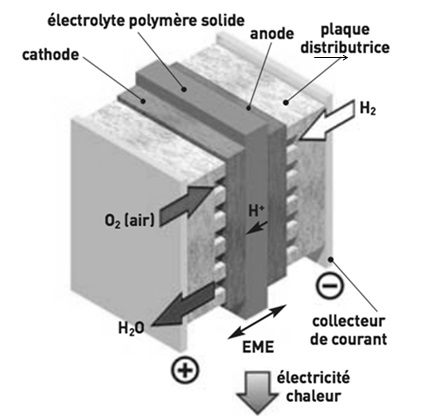
Ecrire les demi-équations électroniques des réactions ayant lieu à
l'anode et à la cathode de la pile à combustible PEFMC. En déduire
l'équation de la réaction globale mise en jeu dans cette pile.
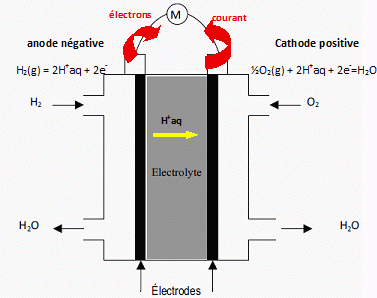
Bilan H2(g) +½O2(g)
---> H2O(l).
2.
Les signes des pôles de la pile à combustible PEFMC indiqués sur le
schéma suivant sont-ils corrects ? Justifier.
A la cathode
positive le dioxygène se réduit. A l'anode négative le dihydrogène
s'oxyde.
Les signes sont corrects.
|
|
|
Problème.
On dispose de galette à base d'hydrure de magnésium. Combien
faudrait-il prévoir de galettes de 760 g pour assurer une autonomie
totale de 10 heures de fonctionnement au véhicule prototype.
Commenter le résultat obtenu et expliquer l'intérêt de ce type de
stockage.
|
|
|
|
Pour
alimenter le moteur du prototype, l'intensité constante du courant
électrique est égale à I = 200 A.
Quantité d'électricité mise en jeu : Q = I t = 200 x10 x3600 = 7,2 106
C.
Quantité de matière d'électrons correspondante : n(e-)=7,2 106
/ (9,65 104) =74,61 mol.
Quantité de matière de dihydrogène : H2(g) =2H+aq
+2e-;
n(H2) = ½n(e-)=0,5
x74,61 ~37,3 mol.
Masse de dihydrogène : 37,3 x M(H2) = 37,3 x 2 ~74,6 g.
La pression d'alimentation en dihydrogène est égale à 0,3 MPa.
Pour obtenir cette pression il faut chauffer la galette d'hydrure
métallique à 320°C.
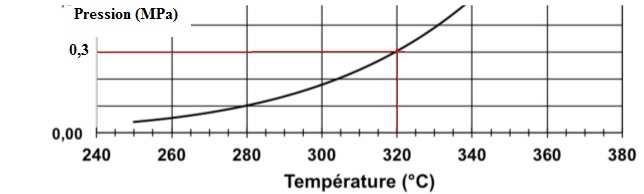
Pourcentage massique d'hydrogène libéré : 0,546 +0,0165 x320 ~5,83 %.
Masse de galette = masse H2 libéré / 0,0583 = 74,6 /0,0583
=1,28 103 g.
Il faut prévoir deux galettes à base d'hydrure de magnésium.
Ce type de stockage est peu encombrant par rapport aux bouteilles
métalliques sous haute pression.
De plus l'hydrure est un solide qui ne présente pas les mêmes risques
d'explosion que le dihydrogène gazeux.
|
|
|
|