Piègeage du
dioxyde de carbone,
bac
S Métropole 09 /2017 .
|
|
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
|
|
Le
développement des technologies de piégeage et stockage du dioxyde de
carbone (gaz à effet de serre) est indispensable pour atténuer la
concentration en dioxyde de carbone dans l’atmosphère (rapport
complémentaire du GIEC, 2014).
Le projet expérimental Carbfix étudie le piégeage du dioxyde de carbone
produit par la centrale électrique de Hellisheidi (Islande). La méthode
utilisée par Carbfix consiste à dissoudre le dioxyde de carbone dans de
l’eau et à le piéger dans des roches basaltiques.
1. Solubilité du dioxyde
de carbone dans l’eau de mer.
Dans le cadre de l’expérience Carbfix, on étudie la possibilité de
dissoudre le dioxyde de carbone dans l’eau de mer dans différentes
conditions physico-chimiques. L’eau de mer sera considérée ici comme
une solution aqueuse de chlorure de sodium à 0,5 mol par kilogramme
d’eau.
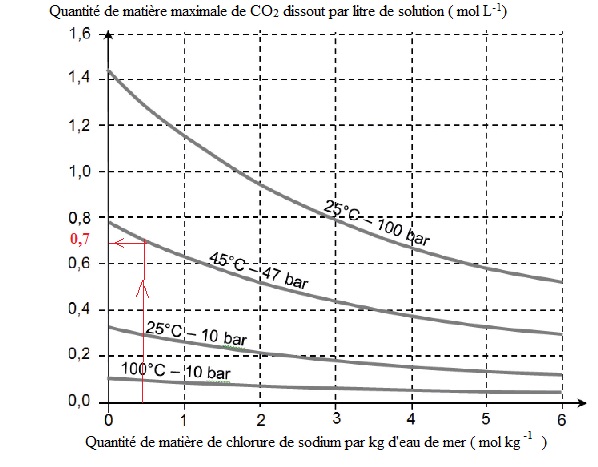
D’après Benoît Dubacq, et al., Geochimica et Cosmochimica Acta, 2013,
110, 229–252.
|
....
.....
|
1.1. À une température de 45 °C et
sous une pression en CO2 de 47 bar, déterminer la quantité
maximale de dioxyde de carbone que l’on peut dissoudre dans un litre
d’eau de mer.
Le ghraphe indique 0,7 mol L-1.
1.2. Dans les mêmes
conditions de température et de pression en CO2, en déduire
le volume d’eau de mer nécessaire pour dissoudre 1 mole de dioxyde de
carbone.
1 / 0,7 ~1,4 L.
1.3. À partir des
documents fournis, indiquer le sens dans lequel il semble préférable de
modifier les paramètres température, pression en CO2 et
teneur en chlorure de sodium de l’eau utilisée pour minimiser le volume
d’eau nécessaire pour réaliser cette dissolution. Justifier brièvement.
La quantité de matière maximale de CO2 dissout augmente avec
la pression.
La
quantité de matière maximale de CO2 dissout augmente lorsque
la quantité de matière de chlorure de sodium par kg d'eau de mer
diminue.
2. Piégeage dans le cadre
du projet CarbFix.
Quand le dioxyde de carbone dissous dans l’eau entre en contact avec
les roches basaltiques, diverses transformations chimiques
interviennent et le consomment. Le piégeage du dioxyde de carbone (CO2)
par ce procédé est prometteur puisqu’il est rapide et sûr. Cependant il
consomme encore trop d’eau : un millier de piscines olympiques serait
nécessaire pour piéger le CO2 produit en un an par la
centrale de Hellisheidi !
On se propose de vérifier cette information en évaluant la quantité
d’eau nécessaire pour ce piégeage. Dans la suite de l’exercice, le
dioxyde de carbone dissous dans l’eau sera noté CO2(aq) pour
simplifier l’écriture des équations de réactions.
Processus chimique de minéralisation du dioxyde de carbone dans le
projet CarbFix
Le dioxyde de carbone gazeux CO2(g) est dissous dans un
courant d’eau qui est injecté en profondeur dans des roches
basaltiques. Le pH de cette solution aqueuse chargée en CO2(aq)
est d’environ 3,5. Le dioxyde de carbone dissous réagit alors avec le
basalte formant des ions hydrogénocarbonate HCO3−
et des cations métalliques qui réagissent alors avec les ions pour
former divers minéraux carbonatés solides.
Données :
- couple acide-base CO2 (aq) / HCO3−
(aq) de pKa = 6,35 à 25 °C ;
- masse molaire du dioxyde de carbone CO2 : 44,0 g.mol-1
;
- dimensions d’une piscine olympique : longueur : L = 50 m ; largeur :
ℓ = 25 m ; profondeur : h =3 m;
- on estimera qu’au moment de son injection dans la roche, la solution
aqueuse de dioxyde de carbone a une concentration molaire C en CO2
(aq) et un pH reliés par la formule suivante :
pH =½(pKa − log C)
Déterminer le volume d’eau nécessaire pour minéraliser les 40 000
tonnes de dioxyde de carbone gazeux produit par la centrale électrique
en un an. Comparer avec l’estimation donnée dans le texte présentant le
procédé Carbfix. |
|
|
Quantité de matière de
dioxyde de carbone :
m = 40 000 x 106 g = 4,0 1010
g.
n = m / M = 4,0 1010 / 44 ~9,1 108 mol.
Concentration C du dioxyde de carbone :
log C = pKa-2 pH =6,35 -2 x3,5 = -0,65 ; C ~0,224 mol / L.
Volume d'eau nécessaire : n / C = 9,1 108 / 0,224 ~4,065 109
L.
Volume d'une piscine olympique : 50 x 25 x3 = 3,75 103 m3 =
3,75 106 L.
Nombre de piscines : 4,065 109 / 3,75 106 ~1084.
De l'ordre de 1000 piscines olympiques, en accord avec le texte.
|
|