Synthèse de la
carvone à partir du limonène,
bac
S Métropole 2017 .
|
|
En
poursuivant votre navigation sur ce site, vous acceptez l’utilisation
de Cookies vous proposant des publicités adaptées à vos centres
d’intérêts.
|
|
|
|
|
|
|
|
La
peau des oranges contient une huile essentielle constituée
principalement d’un des énantiomères du limonène : le R-limonène, qui
est responsable de leur odeur caractéristique. Le R-limonène sert de
matière première pour produire des arômes dans l’industrie
agroalimentaire, comme la R-carvone.
Dans cet exercice, on s’intéresse à la synthèse de la R-carvone à
partir du R-limonène.
1. Extraction du limonène
L'extraction de cette huile essentielle peut se faire par
hydrodistillation. À partir de l’écorce de six oranges, on recueille
3,0 mL d’huile essentielle que l’on analyse par spectrophotométrie.
1.1. Représenter la formule
semi-développée du R-limonène.
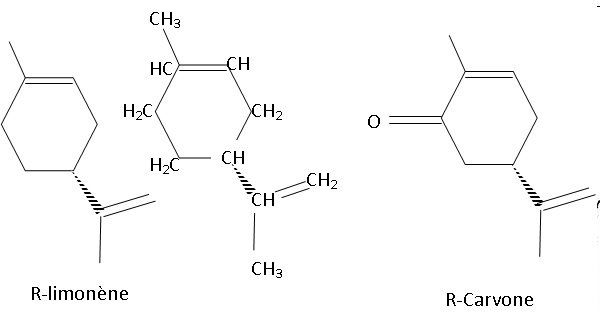
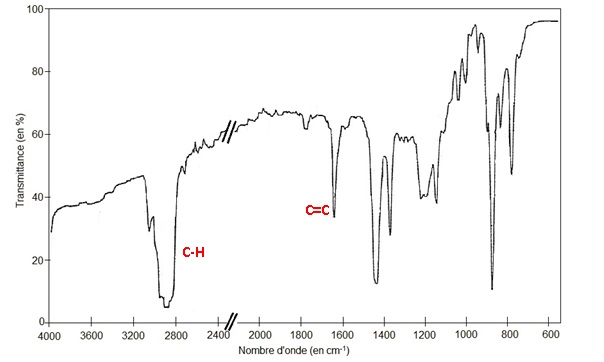
1.2. Montrer que le
spectre infrarouge de l’huile essentielle recueillie est compatible
avec la structure du R-limonène.
D’après : Chimie des couleurs et des odeurs, M. Capon, Culture et
techniques.
2. Synthèse de la R-carvone.
La synthèse de la R-carvone s’effectue à partir du R-limonène en trois
étapes schématisées ainsi :
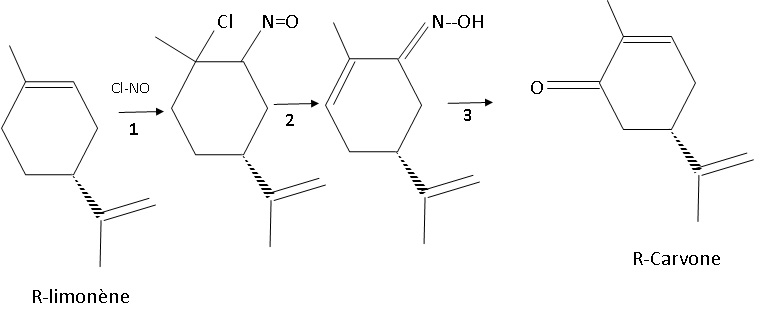
|
|
|
Etape 1. La
réaction entre le limonène et le chlorure de nitrosyle NOCℓ en excès
permet, après filtration, de recueillir un produit sous forme solide :
le nitrosochlorure de limonène.
À
l’issue de la synthèse, on recueille un mélange constitué de deux
phases : une phase aqueuse et une
phase organique constituée principalement de R-carvone. Cette phase
organique est séparée de la phase
aqueuse à l'aide d'une ampoule à décanter, puis la phase organique est
séchée.
2.1. La R-carvone
est une molécule chirale. Justifier.
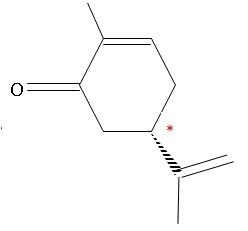
Un atome de carbone asymétrique est un atome de carbone lié à 4 atomes
ou groupes d'atomes différents.
La R carvone possède un atome de carbone asymétrique. Cette molécule
est chirale.
2.2. Indiquer la
catégorie de la réaction mise en jeu lors de la première étape de la
synthèse. Justifier.
Addition sur une double liaison C=C. A partir de deux réactifs, on
obtient un seul produit. Une double liaison est cassée, deux liaisons
simples sont formées.
2.3. Dans l’ampoule
à décanter iIdentifier la phase où se situe la R-carvone. Justifier.
La densité de la R carvone ( phase organique) est égale à 0,96,
inférieure à celle de l'eau. La phase la plus dense occupe la partie
inférieure ( phase 2) et la R carvone la partie supérieure ( phase 1).
|
|
|
|
3. Des
oranges à la carvone
On fait l’hypothèse que l’huile essentielle
recueillie par hydrodistillation (partie 1.) est uniquement constituée
de R-limonène. Le rendement de la synthèse effectuée (partie 2.) est de
30%.
3.1. Vérifier que
la quantité de matière de R-limonène nécessaire à la synthèse de 13 g
de R-carvone est
égale à 0,29 mol.
M(R carvone) = 150,0 g/mol.
Quantité
de matière de R carvone : n =13 / 150,0 = 0,0867 mol.
Quantité
de matière de R limonène : n = 0,0867 mol.
Tenir compte du rendement de 30 % : 0,0867 / 0,30 =0,289 ~0,29 mol.
3.2. Estimer le nombre d'oranges
nécessaire pour synthétiser 13 g de R-carvone à partir du R-limonène
extrait des peaux d’orange.
M(R limonène) = 136,0 g/mol.
Masse de R limonène : m = n x M(Rlimonène)= 0,289 x 136,0 ~39,3 g.
Masse volumique du R limonène : 0,84 g / mL.
Volume de R limonène correspondant : V = 39,3 / 0,84 ~46,8 mL.
À partir de
l’écorce de six oranges, on recueille 3,0 mL d’huile essentielle.
Il faut donc : 46,8 / 3,0 x 6= 93,5 ~94 oranges.
|
|